Essa bateria se esgota quando sua reação
global entra em equilíbrio e a diferença de
potencial se iguala a zero.
 Cd + 2 OH− Eº= − 0,81V
Cd + 2 OH− Eº= − 0,81V Ni(OH)2 + OH− Eº= + 0,49 V
Ni(OH)2 + OH− Eº= + 0,49 V  Cd + 2 OH− Eº= − 0,81V
Cd + 2 OH− Eº= − 0,81V Ni(OH)2 + OH− Eº= + 0,49 V
Ni(OH)2 + OH− Eº= + 0,49 V  Ca(OH)2(aq)
Ca(OH)2(aq) Ca2+(aq) + 2 OH-
(aq)
Ca2+(aq) + 2 OH-
(aq) 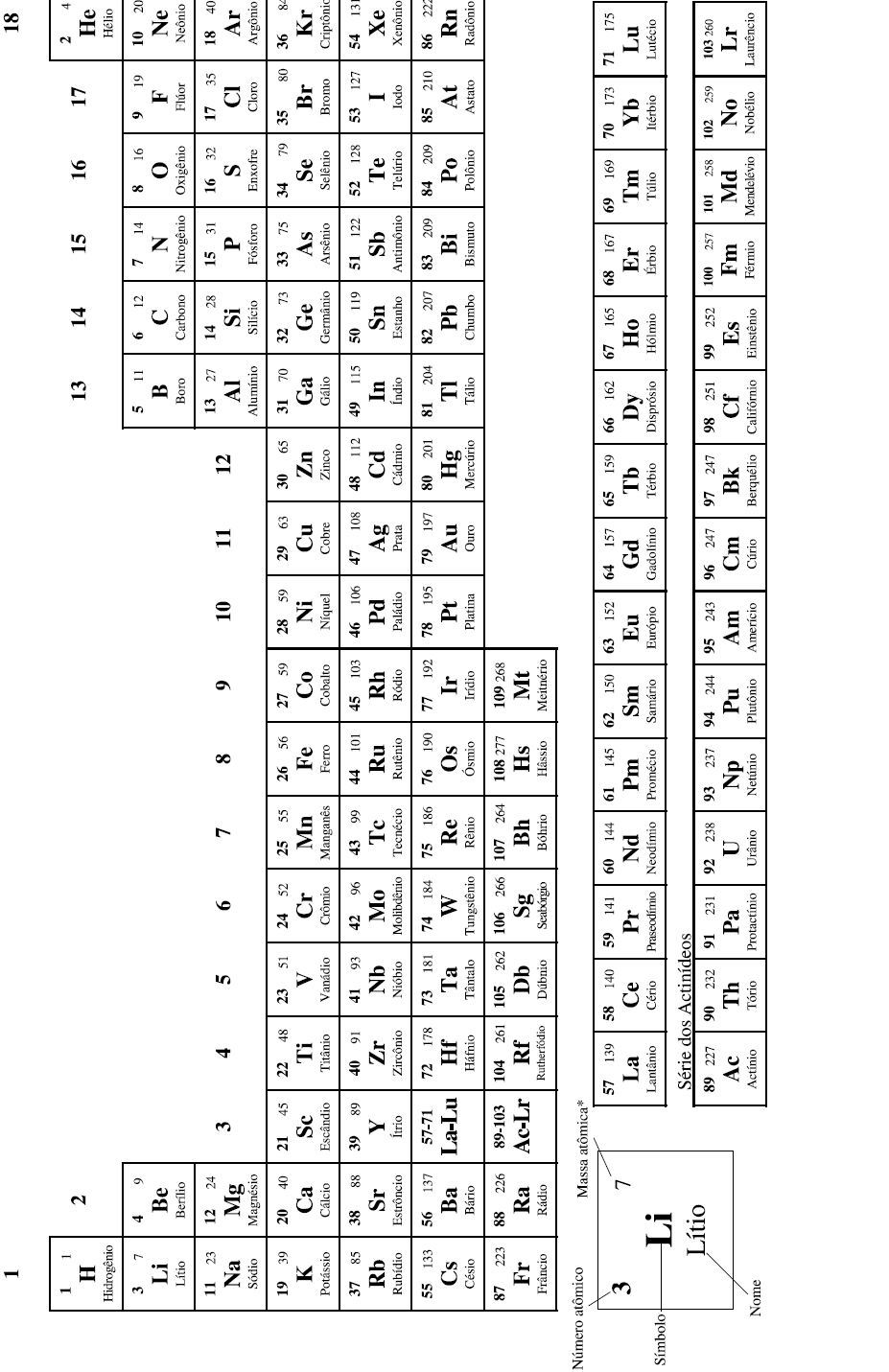
Dentre os equilíbrios químicos,

aquele com Kp = Kc é o
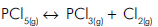

Br2(g) + H2(g) 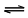 2HBr(g)
2HBr(g)
Um dado sistema em que inicialmente existem apenas reagentes pode convergir para um estado em que há reagentes e produtos coexistindo com concentrações constantes ao longo do tempo. Essas concentrações não se alteram em razão de as reações direta e inversa se processarem com velocidades iguais, o que caracteriza um estado de equilíbrio dinâmico.
De acordo com essas informações e considerando o sistema,
representado pela equação química, formado inicialmente pela
mistura de 1,0mol de Br2(g) com 1,0mol de H2(g), contida em
um recipiente de 10,0L, a determinada temperatura, ao atingir
o estado de equilíbrio, apresentou 0,20mol de HBr, é correto
afirmar:
A constante de equilíbrio, Kc, é representada pela
expressão

 COCl2(g)
COCl2(g)
 COCl2(g)
COCl2(g)
 COCl2(g)
COCl2(g)
 COCl2(g)
COCl2(g)
 COCl2(g)
COCl2(g)

 [CoCl4]
+2
(aq) + 6 H2O(l)
[CoCl4]
+2
(aq) + 6 H2O(l)

 [CoCl4]
+2
(aq) + 6 H2O(l)
[CoCl4]
+2
(aq) + 6 H2O(l)

 [CoCl4]
+2
(aq) + 6 H2O(l)
[CoCl4]
+2
(aq) + 6 H2O(l)

 [CoCl4]
+2
(aq) + 6 H2O(l)
[CoCl4]
+2
(aq) + 6 H2O(l)

 [CoCl4]
+2
(aq) + 6 H2O(l)
[CoCl4]
+2
(aq) + 6 H2O(l)
 NH4OH(aq)
NH4OH(aq)  NH+4 (aq) + OH− (aq)
NH+4 (aq) + OH− (aq)
 H+(aq) + CN-(aq)
H+(aq) + CN-(aq)