O Princípio de Le Chatelier infere que quando uma perturbação é imposta a um sistema químico em equilíbrio, este irá
se deslocar de forma a minimizar tal perturbação.
Disponível em: <brasilescola.com/exercicios-quimica/exercicios-sobre-principio-le-chatelier.htm>
O gráfico apresentado a seguir indica situações referentes à perturbação do equilíbrio químico indicado pela equação
H2(g) + I2(g) 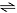
2 HI(g)

A partir da equação química apresentada e da observação do gráfico, considerando também que a reação é endotérmica
em favor da formação do ácido iodídrico, a dinâmica do equilíbrio favorecerá
O Princípio de Le Chatelier infere que quando uma perturbação é imposta a um sistema químico em equilíbrio, este irá se deslocar de forma a minimizar tal perturbação.
Disponível em: <brasilescola.com/exercicios-quimica/exercicios-sobre-principio-le-chatelier.htm>






 Ag(NH3)
Ag(NH3) Ag
Ag Ag(NH
Ag(NH
 Ag
Ag Ag(NH
Ag(NH Ag(NH
Ag(NH



 HbO2
HbO2 2SO2(g) + O2(g)
2SO2(g) + O2(g) H+ (aq) + HCO3– (aq)
H+ (aq) + HCO3– (aq)