O arseneto de gálio, GaAs, é um semicondutor utilizado na
fabricação de células fotoelétricas, transistores e chips para
computadores. Pode ser obtido a partir de reação
representada pela equação química não balanceada.
As(s) + H2(g) + Ga2O3(s)  GaAs(l) + H2O(g)
GaAs(l) + H2O(g)
A partir da análise dessa equação química, após balanceamento
com os menores coeficientes estequiométricos inteiros,
pode-se afirmar:
 GaAs(l) + H2O(g)
GaAs(l) + H2O(g)


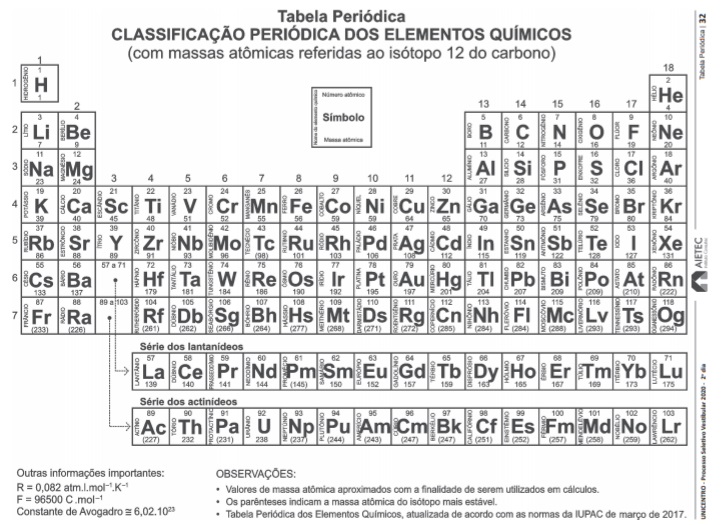


 , na reação acima, encontra-se no estado de oxidação +3 (Fe
, na reação acima, encontra-se no estado de oxidação +3 (Fe