53623f34-36
CEDERJ 2016 - Química - Grandezas: massa, volume, mol, massa molar, constante de Avogadro e Estequiometria., Representação das transformações químicas
Considerando os conceitos de mol e do valor da
constante de Avogadro, é correto afirmar:
Considerando os conceitos de mol e do valor da
constante de Avogadro, é correto afirmar:
A
Um mol de átomos de magnésio contém o mesmo
número de átomos que um mol de átomos de sódio.
B
Um mol de água contém 6.02x1023 átomos.
C
O padrão de medida para a quantidade de matéria
é o oxigênio (O16), por ser mais estável e abundante do que o carbono.
D
O número de moléculas de gás cloro contidas em
1.75 mol corresponde a 10.5x1024 moléculas.
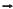 Al 2 O3(s) , não balanceada, pode-se afirmar que a massa de alumínio necessária para produzir 51 g de óxido de alumínio é
Al 2 O3(s) , não balanceada, pode-se afirmar que a massa de alumínio necessária para produzir 51 g de óxido de alumínio é