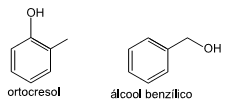
UNESP 2017 - Química - Isomeria: Isomeria Espacial: Isomeria Geométrica (cis-trans) e Isomeria Óptica., Principais Funções Orgânicas: Funções Oxigenadas: Álcool, Fenol e Enol., Química Orgânica, Isomeria: Isomeria Plana: Cadeia, Posição, Compensação, Função e Tautomeria., Principais Funções Orgânicas: Funções Oxigenadas: Cetona, Aldeído, Éter, Éster, Ácido Carboxílico, Anidrido Orgânico e Cloreto de Ácido., Principais Funções Orgânicas: Hidrocarbonetos: Alcano, Alceno, Alcino, Alcadieno, Ciclos Alcano e Alceno, Aromáticos. Haletos., Principais Funções Orgânicas: Funções Nitrogenadas: Amina, Amida, Nitrila, Isonitrila e Nitro Composto.