Questõesde PUC - PR sobre Química
A água é de suma importância à população, então, é extremamente necessário que essa água seja
tratada de maneira correta. Entende-se o tratamento de água como sendo um conjunto de procedimentos físicos
e químicos para torná-la potável. A figura a seguir mostra as etapas do tratamento de água utilizado atualmente.
A respeito do tratamento de água e das etapas referentes a esse processo, assinale a alternativa CORRETA.


O monóxido de carbono é um gás incolor, sem cheiro ou sabor, inflamável e perigoso devido à sua
grande toxicidade e por ser um asfixiante químico. O CO é liberado no ambiente por fontes naturais, por exemplo,
atividade vulcânica, descargas elétricas e emissão de gás natural. Tudo isso é produto da combustão incompleta,
ou seja, queima em condições de pouco oxigênio de combustíveis fósseis (lenha, carvão vegetal e mineral, gasolina, querosene, óleo diesel, gás). Em uma reação de combustão, em recipiente fechado, envolvendo o monóxido
de carbono, mantido à temperatura constante, foram colocados o monóxido de carbono e gás oxigênio, cujas
pressões parciais foram determinadas respectivamente com 4 atm e 1,6 atm, respectivamente. A reação ocorreu
e após certo tempo, quando o equilíbrio foi atingido, verificou-se que a pressão parcial do gás oxigênio, foi de 608
mmHg. Analisando o texto, e a reação não balanceada, dada abaixo, assinale a alternativa CORRETA.
http://www.ecycle.com.br/.
CO(g) + O2 (g) ⟷ CO2(g)
Hoje, tão importante quanto cuidar de uma casa é o cuidado com tanques e outros componentes que retenham água. Uma empresa foi chamada para fazer a limpeza e o controle de um pequeno tanque
artesanal. A água do tanque foi tratada colocando-se o cloreto de sódio, dentre outros componentes. Para isso, mediu-se a concentração da salinidade da água em função do cloreto de sódio, encontrando-se o valor de
2,92 g/L em 0,03 m3 de água do tanque. Adicionou-se 6 dm3 de uma solução 0,7 M ao volume contido no
tanque. Qual a concentração final utilizada em quantidade de matéria e em g/L, respectivamente, de cloreto de
sódio neste tanque?
O plasmalogênio, cuja estrutura é apresentada a seguir, é um tipo de lipídio. Os lipídios são biomoléculas que desempenham inúmeras funções, como composição das membranas celulares, fornecimento de energia, isolamento térmico
entre outras.

Essas funções bioquímicas estão relacionadas a sua estrutura molecular e possíveis reações e interações químicas.
A partir da estrutura apresentada, observamos que

Um dos medicamentos mais utilizados no Brasil para dores e febre, a dipirona monossódica é proibida de ser comercializada nos Estados Unidos e Europa. Sua proibição está relacionada ao fato de que o uso constante dessa substância
pode levar a granulocitopenia que é a acentuada redução de determinados glóbulos brancos. A estrutura molecular da
dipirona monossódica é apresentada a seguir

Com relação à estrutura apresentada, percebe-se que

O ácido nítrico fumegante é tão concentrado e reativo que propicia reações químicas pouco comuns como o fato de o
hidrogênio ácido poder ser deslocado por um elemento nobre como o cobre.
Cu(s) + 4 HNO3(aq) ➔ Cu(NO3)2(aq) + 2 NO2(g) + 2 H2O(l)
De acordo com a equação química apresentada, qual deve ser o volume aproximado, em litros, de gás formado nas
CNTP, considerando que a amostra metálica de cobre de 200 g apresentava 18 % de impurezas em sua composição.
- Considere volume molar nas CNTP = 22,4 L. mol−¹
Nos últimos anos, a discussão sobre questões ambientais se tornou ainda mais comum, entretanto os acordos estabelecidos ainda não tiveram uma aplicação prática e a realidade é a de que os índices de emissão de gases poluentes continuam aumentando. Inúmeras soluções são avaliadas, mas a prática dessas modificações só poderá ser analisada no
futuro para observar se de fato os índices de gases como o dióxido de carbono e o dióxido de enxofre na atmosfera foram
reduzidos. A percepção da diminuição da quantidade desses gases na atmosfera está relacionada ao fato de que
A tabela apresentada a seguir indica a concentração de muitos íons minerais que compõem águas engarrafadas que
fazem parte de nosso cotidiano.
CLASSIFICAÇÃO: Água mineral Fluoretada e Vanádica
CARACTERÍSTICAS FÍSICO-QUÍMICA
pH a 25 °C ........................................................................................................... 6,79
Temperatura da água na fonte ....................................................................... 21,3 °C
Condutividade elétrica a 25 °C .................................................................. 296 uS/cm
Resíduo de evaporação a 180 °C, calculado ........................................... 245,24 mg/L
Radioatividade na fonte a 20 °C e 760 mmHg ........................................ 0,97 maches
COMPOSIÇÃO QUÍMICA (mg/L)
Bicarbonato ..................................................................................................... 158,79
Cálcio ............................................................................................................... 31,426
Sódio ................................................................................................................ 15,583
Magnésio .......................................................................................................... 13,193
Cloreto ................................................................................................................. 8,43
Potássio ............................................................................................................. 0,438
Fluoreto ............................................................................................................... 0,14
Estrôncio ............................................................................................................ 0,111
Vanádio .............................................................................................................. 0,026
Considerando as informações apresentadas, qual é a concentração em mmol/L do único ânion oxigenado apresentado
na tabela?
Os alimentos ricos em asparagina são, principalmente, alimentos ricos em proteína. A asparagina é um
aminoácido não essencial porque independe da ingestão de alimentos ricos em nutrientes, pois o organismo
consegue produzi-lo quando necessário. Uma das funções da asparagina é manter as células do
sistema nervoso saudáveis e contribuir para a formação e manutenção de ossos, pele, unhas e cabelos,
por exemplo. A asparagina serve para formar dentro do organismo novas proteínas de acordo com a necessidade
do organismo em cada momento.
Disponível em: <http://www.tuasaude> .
Analisando o texto e a fórmula da asparagina apresentada a seguir, assinale a alternativa CORRETA.
Dado: Número atômico: H = 1, C = 6, N = 7, O = 8

Os alimentos ricos em asparagina são, principalmente, alimentos ricos em proteína. A asparagina é um aminoácido não essencial porque independe da ingestão de alimentos ricos em nutrientes, pois o organismo consegue produzi-lo quando necessário. Uma das funções da asparagina é manter as células do sistema nervoso saudáveis e contribuir para a formação e manutenção de ossos, pele, unhas e cabelos, por exemplo. A asparagina serve para formar dentro do organismo novas proteínas de acordo com a necessidade do organismo em cada momento.
Disponível em: <http://www.tuasaude>

“O ácido Sulfúrico é tido como um indicador da economia de um país, pois é o produto químico mais utilizado
pela indústria. Sua aplicação tem larga escala, desde em fertilizantes e baterias de automóveis, até
no refino do petróleo. É extremamente solúvel em água, porém, isto deve ser feito com muita cautela,
pois seus vapores são liberados agressivamente”.
Disponível em: <http://www.brasilescola.com/> .
Uma das maneiras de produzi-lo é através das reações com oxigênio, o qual ocupa uma fração de 21%,
aproximadamente, no ar atmosférico. A partir das informações fornecidas e utilizando as reações não balanceadas
apresentadas a seguir, referentes às etapas de produção de ácido sulfúrico, assinale a alternativa
CORRETA.
Dados: (Ma (g/mol): H = 1, O = 16, S= 32). Volume molar na CNTP: 22,71 L/mol, Avogadro = 6X1023
I) S8(s) + O2(g) → SO2(g)
II) SO2(g)+ O2(g) → SO3(g)
III) SO3(g) + H2O (l) → H2SO4 (aq)
“O ácido Sulfúrico é tido como um indicador da economia de um país, pois é o produto químico mais utilizado
pela indústria. Sua aplicação tem larga escala, desde em fertilizantes e baterias de automóveis, até
no refino do petróleo. É extremamente solúvel em água, porém, isto deve ser feito com muita cautela,
pois seus vapores são liberados agressivamente”.
Disponível em: <http://www.brasilescola.com/>
O ácido permangânico é um composto instável, de cor branca, extremamente corrosivo, o qual oxida em
soluções aquosas. Já o hidróxido de ferro III é uma base insolúvel em água que, em conjunto com outras
substâncias, pode servir, por exemplo, em medicina para ajudar a tratar anemias.
Disponível em: <http://www.quimica.seed.pr.gov.br> .
No que diz respeito aos ácidos e bases, assinale a alternativa CORRETA.
Dadas massas atômicas em (g/mol): H = 1, O = 16, Mn = 55, Fe = 56
O ácido permangânico é um composto instável, de cor branca, extremamente corrosivo, o qual oxida em soluções aquosas. Já o hidróxido de ferro III é uma base insolúvel em água que, em conjunto com outras substâncias, pode servir, por exemplo, em medicina para ajudar a tratar anemias.
Disponível em: <http://www.quimica.seed.pr.gov.br>
O sulfato de potássio e o permanganato de potássio são duas importantes substâncias. O sulfato de potássio
é utilizado na agricultura como um dos constituintes dos fertilizantes, pois ajuda na adubação das
culturas que estão com carência de potássio, ao passo que o permanganato de potássio é utilizado no
tratamento da catapora, pois ajuda a secar os ferimentos causados pela doença. A reação a seguir mostra
uma maneira de produzir o sulfato de potássio a partir do permanganato de potássio. Considerando
as informações apresentadas e a análise da reação não balanceada, assinale a alternativa CORRETA.
Dados: massas atômicas em (g/mol): H= 1, O= 16, S = 32, K = 39, Mn = 55
KMnO4(aq) + H2SO4(aq) + H2O2(aq) → K2SO4(aq) + H2O(l) + MnSO4(aq) + O2(g)
O sulfato de potássio e o permanganato de potássio são duas importantes substâncias. O sulfato de potássio é utilizado na agricultura como um dos constituintes dos fertilizantes, pois ajuda na adubação das culturas que estão com carência de potássio, ao passo que o permanganato de potássio é utilizado no tratamento da catapora, pois ajuda a secar os ferimentos causados pela doença. A reação a seguir mostra uma maneira de produzir o sulfato de potássio a partir do permanganato de potássio. Considerando as informações apresentadas e a análise da reação não balanceada, assinale a alternativa CORRETA.
Dados: massas atômicas em (g/mol): H= 1, O= 16, S = 32, K = 39, Mn = 55
KMnO4(aq) + H2SO4(aq) + H2O2(aq) → K2SO4(aq) + H2O(l) + MnSO4(aq) + O2(g)
Os efeitos tóxicos do dióxido de carbono exigem a sua remoção contínua de espaços fechados. A reação
entre hidróxido de lítio e de dióxido de carbono é usada para remover o gás de naves espaciais e submarinos.
O filtro utilizado nestes equipamentos é basicamente composto de hidróxido lítio. O ar seria direcionado
para o filtro através de ventiladores, ao entrar em contato com o hidróxido de lítio presente nos filtros
ocorre a reação com o dióxido de carbono existente no ar. A reação global é exotérmica, formando
carbonato de lítio sólido e água no estado gasoso.
Disponível em: <http://www.abq.org.br/cbq/2014/trabalhos/14/4463-18723.html>.
Analisando o texto e a reação não balanceada, assinale a alternativa CORRETA.
CO2(g) + LiOH(s) → Li2CO3(s) + H2O(v)
Os efeitos tóxicos do dióxido de carbono exigem a sua remoção contínua de espaços fechados. A reação entre hidróxido de lítio e de dióxido de carbono é usada para remover o gás de naves espaciais e submarinos. O filtro utilizado nestes equipamentos é basicamente composto de hidróxido lítio. O ar seria direcionado para o filtro através de ventiladores, ao entrar em contato com o hidróxido de lítio presente nos filtros ocorre a reação com o dióxido de carbono existente no ar. A reação global é exotérmica, formando carbonato de lítio sólido e água no estado gasoso.
Disponível em: <http://www.abq.org.br/cbq/2014/trabalhos/14/4463-18723.html>
A constante de hidrólise deste sal é dada pela seguinte relação:
Kh = [OH- ] . [H2CO3-2] / [CO3-2] . [H2O].
A atmosfera é uma camada de gases que envolve a terra, sua composição em volume é basicamente feita de gás nitrogênio
(78%), gás oxigênio (21%) e 1% de outros gases, e a pressão atmosférica ao nível do mar é de aproximadamente
100000 Pa. A altitude altera a composição do ar, diminui a concentração de oxigênio, tornando-o menos denso,
com mais espaços vazios entre as moléculas; consequentemente, a pressão atmosférica diminui. Essa alteração na
quantidade de oxigênio dificulta a respiração, caracterizando o estado clínico conhecido como hipóxia, que causa náuseas,
dor de cabeça, fadiga muscular e mental, entre outros sintomas. Em La Paz, na Bolívia, capital mais alta do mundo,
situada a 3600 metros acima do nível do mar, a pressão atmosférica é cerca de 60000 Pa e o teor de oxigênio no ar
atmosférico é cerca de 40% menor que ao nível do mar. Os 700.000 habitantes dessa região estão acostumados ao ar
rarefeito da Cordilheira dos Andes e comumente mascam folhas de coca para atenuar os efeitos da altitude. Em La
Paz, a pressão parcial do gás oxigênio, em volume, é aproximadamente de:
Os compostos iônicos e moleculares interferem de formas diferentes na variação da pressão osmótica de um organismo.
Como regra geral, podemos afirmar que, considerando uma mesma quantidade de matéria, os efeitos causados
pelo consumo de sal são mais intensos que os de açúcar. Considere que soluções aquosas diferentes tenham sido
preparadas com 50 g de nitrato de cálcio e 50 g de glicerina (propan-1,2,3-triol), formando dois sistemas em que cada
um apresente 2,0 litros de solução a 20 ºC. A razão existente entre a pressão osmótica do sistema salino em relação à
pressão osmótica do sistema alcólico é, aproximadamente:
Use 0,082 atm.L/mol.K para a constante universal dos gases perfeitos.
Os compostos iônicos e moleculares interferem de formas diferentes na variação da pressão osmótica de um organismo. Como regra geral, podemos afirmar que, considerando uma mesma quantidade de matéria, os efeitos causados pelo consumo de sal são mais intensos que os de açúcar. Considere que soluções aquosas diferentes tenham sido preparadas com 50 g de nitrato de cálcio e 50 g de glicerina (propan-1,2,3-triol), formando dois sistemas em que cada um apresente 2,0 litros de solução a 20 ºC. A razão existente entre a pressão osmótica do sistema salino em relação à pressão osmótica do sistema alcólico é, aproximadamente:
Use 0,082 atm.L/mol.K para a constante universal dos gases perfeitos.
Mais do que classificar os compostos e agrupá-los como funções em virtude de suas semelhanças químicas, a Química
Orgânica consegue estabelecer a existência de inúmeros compostos. Um exemplo dessa magnitude é a isomeria, que
indica que compostos diferentes podem apresentar a mesma fórmula molecular. A substância a seguir apresenta vários
tipos de isomeria, algumas delas perceptíveis em sua fórmula estrutural e outras a partir do rearranjo de seus átomos,
que poderiam formar outros isômeros planos.

A partir da estrutura apresentada, as funções orgânicas que podem ser observadas e o número de isômeros opticamente
ativos para o referido composto são, respectivamente:
Mais do que classificar os compostos e agrupá-los como funções em virtude de suas semelhanças químicas, a Química Orgânica consegue estabelecer a existência de inúmeros compostos. Um exemplo dessa magnitude é a isomeria, que indica que compostos diferentes podem apresentar a mesma fórmula molecular. A substância a seguir apresenta vários tipos de isomeria, algumas delas perceptíveis em sua fórmula estrutural e outras a partir do rearranjo de seus átomos, que poderiam formar outros isômeros planos.

A partir da estrutura apresentada, as funções orgânicas que podem ser observadas e o número de isômeros opticamente
ativos para o referido composto são, respectivamente:
O airbag é um equipamento de segurança na forma de bolsas infláveis que protege os ocupantes de veículos em caso
de acidente e tem como princípio fundamental reações químicas. Esse dispositivo é constituído de pastilhas contendo
azida de sódio e nitrato de potássio, que são acionadas quando a unidade de controle eletrônico envia um sinal elétrico
para o ignitor do gerador de gás. A reação de decomposição da azida de sódio (NaN3) ocorre a 300 °C e é instantânea,
mais rápida que um piscar de olhos, cerca de 20 milésimos de segundo, e desencadeia a formação de sódio metálico e
nitrogênio molecular, que rapidamente inflam o balão do airbag. O nitrogênio formado na reação é um gás inerte, não
traz nenhum dano à saúde, mas o sódio metálico é indesejável. Como é muito reativo, acaba se combinando com o nitrato
de potássio, formando mais nitrogênio gasoso e óxidos de sódio e potássio, segundo as reações a seguir:
NaN3 → Na + N2
Na + KNO3 → K2O + Na2O + N2
Considerando uma pastilha de 150 g de azida de sódio com 90% de pureza, o volume aproximado de gás nitrogênio
produzido nas condições ambientes é de:
Dados: Volume molar de gás nas condições ambientes = 25 L/mol e massa molar do NaN3 = 65 g/mol.
O airbag é um equipamento de segurança na forma de bolsas infláveis que protege os ocupantes de veículos em caso de acidente e tem como princípio fundamental reações químicas. Esse dispositivo é constituído de pastilhas contendo azida de sódio e nitrato de potássio, que são acionadas quando a unidade de controle eletrônico envia um sinal elétrico para o ignitor do gerador de gás. A reação de decomposição da azida de sódio (NaN3) ocorre a 300 °C e é instantânea, mais rápida que um piscar de olhos, cerca de 20 milésimos de segundo, e desencadeia a formação de sódio metálico e nitrogênio molecular, que rapidamente inflam o balão do airbag. O nitrogênio formado na reação é um gás inerte, não traz nenhum dano à saúde, mas o sódio metálico é indesejável. Como é muito reativo, acaba se combinando com o nitrato de potássio, formando mais nitrogênio gasoso e óxidos de sódio e potássio, segundo as reações a seguir:
NaN3 → Na + N2
Na + KNO3 → K2O + Na2O + N2
Considerando uma pastilha de 150 g de azida de sódio com 90% de pureza, o volume aproximado de gás nitrogênio produzido nas condições ambientes é de:
Dados: Volume molar de gás nas condições ambientes = 25 L/mol e massa molar do NaN3 = 65 g/mol.
O Princípio de Le Chatelier infere que quando uma perturbação é imposta a um sistema químico em equilíbrio, este irá
se deslocar de forma a minimizar tal perturbação.
Disponível em: <brasilescola.com/exercicios-quimica/exercicios-sobre-principio-le-chatelier.htm>
O gráfico apresentado a seguir indica situações referentes à perturbação do equilíbrio químico indicado pela equação
H2(g) + I2(g) 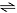
2 HI(g)

A partir da equação química apresentada e da observação do gráfico, considerando também que a reação é endotérmica
em favor da formação do ácido iodídrico, a dinâmica do equilíbrio favorecerá
O Princípio de Le Chatelier infere que quando uma perturbação é imposta a um sistema químico em equilíbrio, este irá se deslocar de forma a minimizar tal perturbação.
Disponível em: <brasilescola.com/exercicios-quimica/exercicios-sobre-principio-le-chatelier.htm>
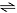

Em relação a essa substância, suas características químicas e reações, nota-se que
O ácido sulfúrico é uma das substâncias mais conhecidas da Química, suas aplicações são diversas, pois este ácido é o mais utilizado na indústria e devido a isso ele serve como um medidor de índice industrial de um país, pois quanto mais há consumo desta substância, mais desenvolvida é a indústria local. O fator negativo dessa grande utilização é o agravamento dos processos de chuva ácida devido a uma maior liberação de compostos de enxofre. A seguir, estão listadas algumas das suas aplicações.
• Produção de ácido fosfórico.
• Refinaria de petróleo.
• Baterias automotivas.
• Fabricação de fertilizantes transformando alguns componentes insolúveis em solúveis.
• Fabricação de explosivos.
• Fabricação de tintas e papel.
Fonte: <http://www.infoescola.com/quimica/acido-sulfurico/>