Questõessobre Grandezas: massa, volume, mol, massa molar, constante de Avogadro e Estequiometria.
O volume de SO2
gasoso, medido nas CNTP, necessário
para transformar 250 mL de solução aquosa 0,100 mol/L
de NaOH em solução de Na2SO3(aq) é

A mistura de dihidrogeno-pirofosfato de sódio com hidrogenocarbonato de sódio, de acordo com a equação química, é
utilizada como fermento químico na produção industrial de
bolos, pães e biscoitos. Essa é uma forma rápida de fazer
expandir, durante o aquecimento, a massa para o preparo
desses alimentos, em relação à utilizada com fermento
biológico.
Considerando-se essas informações, é correto afirmar:

A mistura de dihidrogeno-pirofosfato de sódio com hidrogenocarbonato de sódio, de acordo com a equação química, é utilizada como fermento químico na produção industrial de bolos, pães e biscoitos. Essa é uma forma rápida de fazer expandir, durante o aquecimento, a massa para o preparo desses alimentos, em relação à utilizada com fermento biológico.
Considerando-se essas informações, é correto afirmar:

O peróxido de hidrogênio, H2O2(l), é um líquido incolor
espesso, empregado como antisséptico e alvejante, a
depender da concentração. Ao reagir com algumas
substâncias, o peróxido de hidrogênio pode atuar como
oxidante ou redutor. A equação química não balanceada
representa a reação do íon permanganato com o peróxido de
hidrogênio.
A partir dessas informações e após o balanceamento dessa
equação química com os menores coeficientes
estequiométricos inteiros, é correto afirmar:

O peróxido de hidrogênio, H2O2(l), é um líquido incolor espesso, empregado como antisséptico e alvejante, a depender da concentração. Ao reagir com algumas substâncias, o peróxido de hidrogênio pode atuar como oxidante ou redutor. A equação química não balanceada representa a reação do íon permanganato com o peróxido de hidrogênio.
A partir dessas informações e após o balanceamento dessa
equação química com os menores coeficientes
estequiométricos inteiros, é correto afirmar:
O dihidrogenofosfato de sódio, NaH2PO4, é um conservante
utilizado em alimentos.
Em relação a esse conservante, é correto afirmar:
O dihidrogenofosfato de sódio, NaH2PO4, é um conservante utilizado em alimentos.
Em relação a esse conservante, é correto afirmar:
Uma das principais utilizações da ureia na indústria é na produção de fertilizantes agrícolas, que possibilitam um aumento
na produção de alimentos. A ureia pode ser obtida por meio
da reação representada pela equação:

Em uma reação de formação da ureia, com 100% de rendimento, foram empregados 68 kg de amoníaco e 110 kg de
gás carbônico.
A quantidade máxima de ureia formada nessas condições e o
reagente em excesso são

Um átomo de um elemento metálico tem massa igual a
1,52 × 10–22 g. Considerando a constante de Avogadro igual
a 6 × 1023 mol–1
, a massa molar desse elemento é
A vitamina C apresenta a estrutura química mostrada a seguir. Linus Pauling, ganhador dos prêmios Nobel de Química e da Paz, ingeria diariamente entre 4 e 6 gramas dessa vitamina, por acreditar nos seus efeitos terapêuticos. No entanto, recomenda-se somente a ingestão diária de 3,5 x 10-4 mol dessa vitamina. Sobre essas informações, assinale o que for correto.
Linus Pauling, ganhador dos prêmios Nobel de Química e da Paz, ingeria diariamente entre 4 e 6 gramas dessa vitamina, por acreditar nos seus efeitos terapêuticos. No entanto, recomenda-se somente a ingestão diária de 3,5 x 10-4 mol dessa vitamina. Sobre essas informações, assinale o que for correto.
A ingestão diária de vitamina C feita por Linus
Pauling aproximava-se a 1.000 vezes do valor
recomendado.

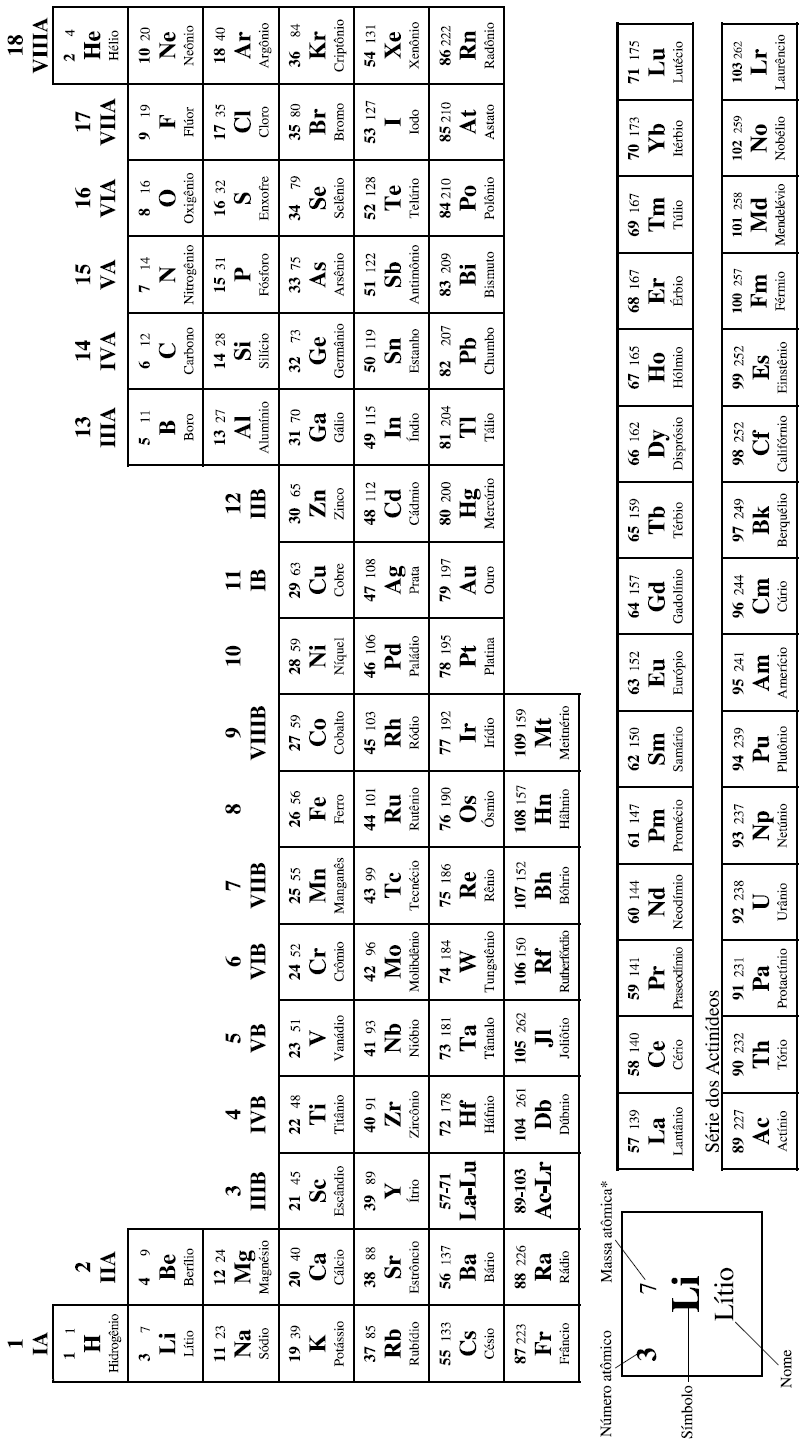
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
Considerando a reação abaixo, em que o coeficiente estequiométrico “x” é uma incógnita, assinale o que for correto.
Al(OH)3(aq) + 3/2 H2SO4(aq) ===> 1/2 Al2(SO4)3(s) + x H2O(l)
Em meio mol do sal, existem 2 mols de átomos de
alumínio.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
Considerando a reação abaixo, em que o coeficiente estequiométrico “x” é uma incógnita, assinale o que for correto.
Al(OH)3(aq) + 3/2 H2SO4(aq) ===> 1/2 Al2(SO4)3(s) + x H2O(l)
3 mols de ácido reagem com 12,04 x 1023 moléculas
de base.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
Considerando a reação abaixo, em que o coeficiente
estequiométrico “x” é uma incógnita, assinale o que for
correto.
Al(OH)3(aq) + 3/2 H2SO4(aq) ===> 1/2 Al2(SO4)3(s) + x H2O(l)
Ao se reagir 156 g da base, irá se formar 342 g do sal.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
Assinale o que for correto.
Os calcogênios possuem maior densidade (ou
densidade absoluta) do que os halogênios.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
No sangue humano, uma concentração de
ácido úrico no valor de 4,5 x 10– 4 mol/dL, está
fora da faixa de normalidade.
A combustão completa de um mol de moléculas do
biodiesel C17H35COOCH2CH3 produzirá 20 mols de
CO2 e 20 mols de água.
O número total de átomos de alumínio contidos
no disco é 1,5x1025.
Um disco circular feito de alumínio de alta pureza, com 20,0 cm de raio, espessura de 2,0 mm e massa de 675,0 g, gira em torno de um eixo fixo em seu centro, descrevendo ângulos de 30º a cada 2,0 segundos.
Dados:
Considerando o exposto, assinale o que for correto.
No disco, existem cerca de 250 mols de
alumínio.

Um disco circular feito de alumínio de alta pureza, com 20,0 cm de raio, espessura de 2,0 mm e massa de 675,0 g, gira em torno de um eixo fixo em seu centro, descrevendo ângulos de 30º a cada 2,0 segundos.
Dados:
Considerando o exposto, assinale o que for correto.
Para os compostos H2S, H2Se e H2Te, a
temperatura de ebulição é função crescente da
massa molecular.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

Observe atentamente o quadro a seguir, cujos valores de temperatura de ebulição foram medidos sob pressão de 1,0 atm.
O principal produto da reação apresentada na Equação A é o isômero
p,p’-DDT. Um químico tratou uma amostra de DDT de modo a obter
apenas esse isômero. Em seguida foi feita uma análise elementar de
cloro e foi encontrado 1,75 mol de Cl para cada mol de clorobenzeno
consumido. Qual o rendimento da reação de formação desse isômero?
Durante décadas, o DDT(dicloro-difenil-tricloroetano) foi largamente usado como inseticida até ser comprovado que, além de provocar câncer, demora de 4 a 30 anos para se degradar. O DDT foi utilizado na Segunda Guerra Mundial para prevenção de tifo em soldados, que o utilizavam também para o combate a piolhos. Posteriormente foi usado na agropecuária, no Brasil e no mundo, dado seu baixo preço e elevada eficiência. Especialistas afirmam que o principal problema do DDT é sua ação indiscriminada, que atinge tanto as pragas quanto o resto da fauna e flora da área afetada. O DDT também se infiltra na água, contaminando os mananciais.

A respeito da combustão completa de 1 mol de gás propano, no estado padrão,
são feitas as seguintes afirmações:
I. Trata-se de um processo endotérmico.
II. Ocorre com liberação de energia para o meio externo.
III. Há a formação de 3 mols de dióxido de carbono e 4 mols de água.
IV. São consumidos 5 mols de gás oxigênio.
Analisando-se as afirmações acima, estão corretas somente
I. Trata-se de um processo endotérmico.
II. Ocorre com liberação de energia para o meio externo.
III. Há a formação de 3 mols de dióxido de carbono e 4 mols de água.
IV. São consumidos 5 mols de gás oxigênio.
Analisando-se as afirmações acima, estão corretas somente
Na reação de neutralização, representada pela equação não balanceada,
quando são misturados 444 g de Ca(OH)2 e 294 g de H3PO4,
Ca(OH)2 + H3PO4 → Ca3(PO4)2 + H2O
Dados: Massas molares, em g∙mol-1, H2O = 18,
Ca(OH)2 = 74, H3PO4 = 98 e Ca3(PO4)2 = 310
é INCORRETO afirmar que
é INCORRETO afirmar que