O benzeno sofre reação de combustão segundo a equação
balanceada
C6H6(ℓ) + 15/2 O2 (g) → 6 CO2(g) + 3 H2O (ℓ)
A entalpia de combustão do benzeno pode ser
determinada conhecendo-se os valores das entalpias de
formação do gás carbônico, assim como da água e do
benzeno líquidos.
A tabela apresenta os valores de entalpia de formação de
algumas substâncias nas condições padrão.
Substância Entalpia de formação
(kJ/mol)
C6H6(ℓ) + 50 CO2(g) – 394
H2O (ℓ) – 286
A entalpia de combustão completa do benzeno,
em kJ/mol, é
Leia o texto para responder a questão.
De onde vem o cheiro de carro novo?
De acordo com o gerente de uma montadora de veículos, o cheiro é composto por uma combinação de vários tipos de substâncias químicas usadas na fabricação do veículo, incluindo solventes, plásticos, colas, tecidos e borracha. Porém, muitas delas são altamente tóxicas, porque contêm Compostos Orgânicos Voláteis (COVs) em sua composição, como benzeno, tolueno e formol, que podem ser letais dependendo da quantidade. Eles acabam escapando e impregnando o ar, porque não requerem altas temperaturas para evaporarem.
<http://tinyurl.com/y8ucob6c> Acesso em: 13.11.2017. Adaptado.

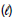
 + 3O
+ 3O ΔH = - 1366,8kJ
ΔH = - 1366,8kJ + 25/2 O
+ 25/2 O ΔH = –5 461,0 kJ
ΔH = –5 461,0 kJ




