Cálculos renais, conhecidos popularmente por “pedras nos rins”,
consistem principalmente em oxalato de cálcio, CaC2O4, espécie
cuja constante de solubilidade (Kps) é de aproximadamente
2 × 10−9
. Os íons oxalato, presentes em muitos vegetais, reagem
com os íons cálcio para formar oxalato de cálcio, que pode
gradualmente se acumular nos rins. Supondo que a concentração
de íons cálcio no plasma sanguíneo seja de cerca de
5 × 10−3
mol/L, qual seria a concentração mínima, em mol/L, de
íons oxalato para que CaC2O4 precipitasse?
Note e adote:
Desconsidere a presença de quaisquer
outros íons e considere que a
concentração no plasma é determinante
para a precipitação do oxalato.
Cálculos renais, conhecidos popularmente por “pedras nos rins”, consistem principalmente em oxalato de cálcio, CaC2O4, espécie cuja constante de solubilidade (Kps) é de aproximadamente 2 × 10−9 . Os íons oxalato, presentes em muitos vegetais, reagem com os íons cálcio para formar oxalato de cálcio, que pode gradualmente se acumular nos rins. Supondo que a concentração de íons cálcio no plasma sanguíneo seja de cerca de 5 × 10−3 mol/L, qual seria a concentração mínima, em mol/L, de íons oxalato para que CaC2O4 precipitasse?
Note e adote:
Desconsidere a presença de quaisquer
outros íons e considere que a
concentração no plasma é determinante
para a precipitação do oxalato.


















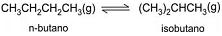
 de concentração 1,2 mol/L
de concentração 1,2 mol/L

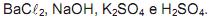



 ao solo, de pH 5,6 , faria a planta gerar flores rosadas.
ao solo, de pH 5,6 , faria a planta gerar flores rosadas.  (NO3)3 ao solo, em que está uma planta com flores azuis, faria com que ela gerasse flores rosadas.
(NO3)3 ao solo, em que está uma planta com flores azuis, faria com que ela gerasse flores rosadas. 