8dde579a-4a
UFRN 2009 - Química - Equilíbrio Químico, Sistemas Homogêneos: Constantes: Kc e Kp. Deslocamento do Equilíbrio: Fatores.
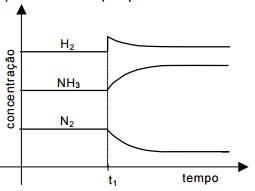
O equi líbrio químico se caracteriza por ser uma dinâmica em nível microscópico. Para se ter uma informação quantitativa da extensão do equi líbrio químico, usa-se a grandeza constante de equi líbrio.
Considere a tirinha a seguir.

Apl icada ao equi líbrio químico, a idéia que o personagem tem sobre equi líbrio
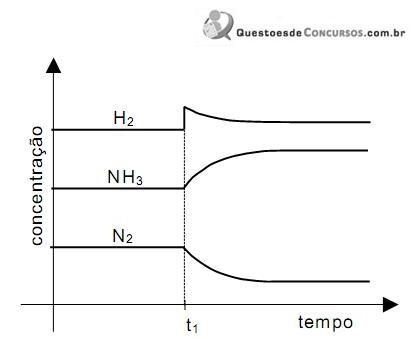
O equi líbrio químico se caracteriza por ser uma dinâmica em nível microscópico. Para se ter uma informação quantitativa da extensão do equi líbrio químico, usa-se a grandeza constante de equi líbrio.
Considere a tirinha a seguir.

Apl icada ao equi líbrio químico, a idéia que o personagem tem sobre equi líbrio
Considere a tirinha a seguir.

Apl icada ao equi líbrio químico, a idéia que o personagem tem sobre equi líbrio
A
é correta, pois, no equilíbrio químico, metade das quantidades sempre é de produtos, e a outra metade é de reagentes.
B
não é correta, pois, no equi líbrio químico, as concentrações de produtos e as de reagentes podem ser diferentes, mas são constantes.
C
é correta, pois, no equi líbrio químico, as concentrações de reagentes e as de produtos sempre são iguais, desde que o equi líbrio não seja perturbado por um efeito externo.
D
não é correta, pois, no equilíbrio químico, as concentrações dos produtos sempre são maiores que as dos reagentes, desde que o equilíbrio não seja afetado por um fator externo.

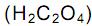 , como acelga, soja e cacau, dificultam a absorção dos íons Ca 2+ pelo intestino.
, como acelga, soja e cacau, dificultam a absorção dos íons Ca 2+ pelo intestino. 
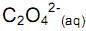 deslocando o equilíbrio para os produtos.
deslocando o equilíbrio para os produtos.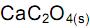 , deslocando o equilíbrio para os reagentes.
, deslocando o equilíbrio para os reagentes.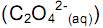 desloca o equilíbrio, aumentando a quantidade de
desloca o equilíbrio, aumentando a quantidade de 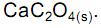
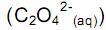 desloca o equilíbrio no sentido de aumentar a quantidade de Ca 2+ (aq).
desloca o equilíbrio no sentido de aumentar a quantidade de Ca 2+ (aq).
 como acelga, soja e cacau, dificultam a absorção dos íons Ca 2+ pelo intestino.
como acelga, soja e cacau, dificultam a absorção dos íons Ca 2+ pelo intestino.
 deslocando o equilíbrio para os produtos.
deslocando o equilíbrio para os produtos. deslocando o equilíbrio para os reagentes.
deslocando o equilíbrio para os reagentes. desloca o equilíbrio, aumentando a quantidade de
desloca o equilíbrio, aumentando a quantidade de 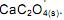
 desloca o equilíbrio no sentido de aumentar a quantidade de Ca 2+ (aq)
desloca o equilíbrio no sentido de aumentar a quantidade de Ca 2+ (aq)