6773904a-bf
ENEM 2012 - Química - Equilíbrio Químico, Sistemas Homogêneos: Equilíbrio Químico na Água: pH e pOH, Indicadores Ácido-Base, Solução Tampão., Soluções e Substâncias Inorgânicas, Substâncias Inorgânicas e suas características: Ácidos, Bases, Sais e Óxidos. Reações de Neutralização.
Uma dona de casa acidentalmente deixou cair na geladeira a água proveniente do degelo de um peixe, o que deixou um cheiro forte e desagradável dentro do eletrodoméstico. Sabe-se que o odor característico de peixe se deve às aminas e que esses compostos se comportam como bases.
Na tabela são listadas as concentrações hidrogeniônicas de alguns materiais encontrados na cozinha, que a dona de casa pensa em utilizar na limpeza da geladeira.
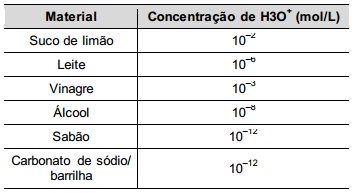
Dentre os materiais listados, quais são apropriados para amenizar esse odor?
Uma dona de casa acidentalmente deixou cair na geladeira a água proveniente do degelo de um peixe, o que deixou um cheiro forte e desagradável dentro do eletrodoméstico. Sabe-se que o odor característico de peixe se deve às aminas e que esses compostos se comportam como bases.
Na tabela são listadas as concentrações hidrogeniônicas de alguns materiais encontrados na cozinha, que a dona de casa pensa em utilizar na limpeza da geladeira.

Dentre os materiais listados, quais são apropriados para amenizar esse odor?
Na tabela são listadas as concentrações hidrogeniônicas de alguns materiais encontrados na cozinha, que a dona de casa pensa em utilizar na limpeza da geladeira.

Dentre os materiais listados, quais são apropriados para amenizar esse odor?
A
Álcool ou sabão.
B
Suco de limão ou álcool.
C
Suco de limão ou vinagre.
D
Suco de limão, leite ou sabão.
E
Sabão ou carbonato de sódio/barrilha.

 pelo cátion do metal.
pelo cátion do metal. pelo cátion do metal.
pelo cátion do metal.


