Questõesde ENEM sobre Química
Nos dias atuais, o amplo uso de objetos de plástico
gera bastante lixo, que muitas vezes é eliminado pela
população por meio da queima. Esse procedimento é
prejudicial ao meio ambiente por lançar substâncias
poluentes. Para constatar esse problema, um estudante
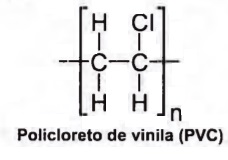
analisou a decomposição térmica do policloreto de
vinila (PVC), um tipo de plástico, cuja estrutura é
representada na figura.
Para realizar esse experimento, o estudante colocou
uma amostra de filme de PVC em um tubo de ensaio e o
aqueceu, promovendo a decomposição térmica. Houve a
liberação majoritária de um gás diatômico heteronuclear
que foi recolhido em um recipiente acoplado ao tubo
de ensaio. Esse gás, quando borbulhado em solução
alcalina diluída contendo indicador ácido-base, alterou a
cor da solução. Além disso, em contato com uma solução
aquosa de carbonato de sódio (Na2CO3), liberou gás
carbônico.
Qual foi o gás liberado majoritariamente na decomposição
térmica desse tipo de plástico?

A obtenção de óleos vegetais, de maneira geral, passa pelas etapas descritas no quadro.
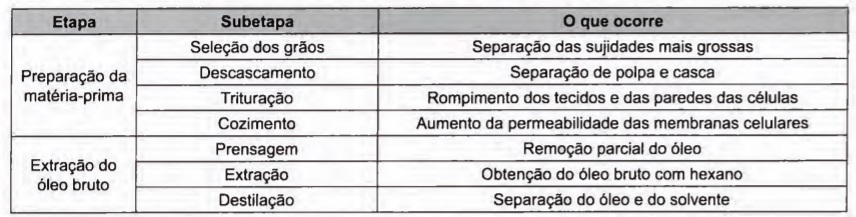
Qual das subetapas do processo é realizada em função apenas da polaridade das substâncias?
A obtenção de óleos vegetais, de maneira geral, passa pelas etapas descritas no quadro.

Qual das subetapas do processo é realizada em função apenas da polaridade das substâncias?
A nanotecnologia pode ser caracterizada quando os
compostos estão na ordem de milionésimos de milímetros,
como na utilização de nanomateriais catalíticos nos
processos industriais. O uso desses materiais aumenta
a eficiência da produção, consome menos energia e gera
menores quantidades de resíduos. O sucesso dessa
aplicação tecnológica muitas vezes está relacionado ao
aumento da velocidade da reação química envolvida.
O êxito da aplicação dessa tecnologia é por causa
da realização de reações químicas que ocorrem em
condições de
Para garantir que produtos eletrônicos estejam
armazenados de forma adequada antes da venda,
algumas empresas utilizam cartões indicadores de
umidade nas embalagens desses produtos. Alguns
desses cartões contêm um sal de cobalto que
muda de cor em presença de água, de acordo com
a equação química:
CoCI2(s) + 6 H2O (g) ⇌ CoCI2 • 6H2O (s) ΔH<0
(azul) (rosa)
Como você procederia para reutilizar, num curto
intervalo de tempo, um cartão que já estivesse com a
coloração rosa?
Para garantir que produtos eletrônicos estejam armazenados de forma adequada antes da venda, algumas empresas utilizam cartões indicadores de umidade nas embalagens desses produtos. Alguns desses cartões contêm um sal de cobalto que muda de cor em presença de água, de acordo com a equação química:
CoCI2(s) + 6 H2O (g) ⇌ CoCI2 • 6H2O (s) ΔH<0
(azul) (rosa)
Como você procederia para reutilizar, num curto intervalo de tempo, um cartão que já estivesse com a coloração rosa?
Em 2011, uma falha no processo de perfuração
realizado por uma empresa petrolífera ocasionou
derramamento de petróleo na bacia hidrográfica de
Campos, no Rio de Janeiro.
Os impactos decorrentes desse derramamento ocorrem
porque os componentes do petróleo
Em seu laboratório, um técnico em química foi
incumbido de tratar um resíduo, evitando seu descarte
direto no meio ambiente. Ao encontrar o frasco, observou
a seguinte informação: “Resíduo: mistura de acetato de
etila e água".
Considere os dados do acetato de etila:
• Baixa solubilidade em água;
• Massa específica = 0,9 g cm-3;
• Temperatura de fusão = - 83 °C;
• Pressão de vapor maior que a da água.
A fim de tratar o resíduo, recuperando o acetato de etila,
o técnico deve
O crescimento da frota de veículos em circulação
no mundo tem levado à busca e desenvolvimento
de tecnologias que permitam minimizar emissões de
poluentes atmosféricos. O uso de veículos elétricos é
uma das propostas mais propagandeadas por serem de
emissão zero. Podemos comparar a emissão de carbono
na forma de CO2 (massa molar igual a 44 g mol-1) para os
dois tipos de carros (a combustão e elétrico). Considere que os veículos tradicionais a combustão, movidos a
etanol (massa molar igual a 46 g mol-1), emitem uma
média de 2,6 mol de CO2 por quilômetro rodado, e os
elétricos emitem o equivalente a 0,45 mol de CO2 por
quilômetro rodado (considerando as emissões na geração
e transmissão da eletricidade). A reação de combustão
do etanol pode ser representada pela equação química:
C2H5OH (I) + 3 O2 (g) → 2 CO2 (g) + 3 H2O (g)
Foram analisadas as emissões de CO2 envolvidas
em dois veículos, um movido a etanol e outro elétrico,
em um mesmo trajeto de 1.000 km.
CHIARADIA, C. A. Estudo da viabilidade da implantação de frotas de veículos elétricos
e híbridos elétricos no atual cenário econômico, político, energético e ambiental brasileiro.
Guaratinguetá: Unesp. 2015 (adaptado).
A quantidade equivalente de etanol economizada, em
quilograma, com o uso do veículo elétrico nesse trajeto,
é mais próxima de
A sacarase (ou invertase) é uma enzima que atua no
intestino humano hidrolisando o dissacarídeo sacarose
nos monossacarídeos glicose e frutose. Em um estudo
cinético da reação de hidrólise da sacarose (C12H22O11),
foram dissolvidos 171 g de sacarose em 500 mL de
água. Observou-se que, a cada 100 minutos de reação,
a concentração de sacarose foi reduzida à metade,
qualquer que fosse o momento escolhido como tempo
inicial. As massas molares dos elementos H, C e O são
iguais a 1, 12 e 16 g mol-1, respectivamente.
Qual é a concentração de sacarose depois de 400 minutos
do início da reação de hidrólise?
2,50 x 10-3 mol L-1
Antigamente, em lugares com invernos rigorosos,
as pessoas acendiam fogueiras dentro de uma sala
fechada para se aquecerem do frio. O risco no uso
desse recurso ocorria quando as pessoas adormeciam
antes de apagarem totalmente a fogueira, o que poderia
levá-las a óbito, mesmo sem a ocorrência de incêndio.
A causa principal desse risco era o(a)
Nos municípios onde foi detectada a resistência do
Aedes aegypti, o larvicida tradicional será substituído
por outro com concentração de 10% (v/v) de um novo
princípio ativo. A vantagem desse segundo larvicida é
que uma pequena quantidade da emulsão apresenta
alta capacidade de atuação, o que permitirá a condução
de baixo volume de larvicida pelo agente de combate às
endemias. Para evitar erros de manipulação, esse novo
larvicida será fornecido em frascos plásticos e, para uso
em campo, todo o seu conteúdo deve ser diluído em água
até o volume final de um litro. O objetivo é obter uma
concentração final de 2% em volume do princípio ativo.
Que volume de larvicida deve conter o frasco plástico?
O processo de calagem consiste na diminuição da
acidez do solo usando compostos inorgânicos, sendo o
mais usado o calcário dolomítico, que é constituído de
carbonato de cálcio (CaCO3) e carbonato de magnésio
(MgCO3). Além de aumentarem o pH do solo, esses
compostos são fontes de cálcio e magnésio, nutrientes
importantes para os vegetais.
Os compostos contidos no calcário dolomítico elevam o
pH do solo, pois
Laboratórios de química geram como subprodutos
substâncias ou misturas que, quando não têm mais
utilidade nesses locais, são consideradas resíduos
químicos. Para o descarte na rede de esgoto, o resíduo
deve ser neutro, livre de solventes inflamáveis e
elementos tóxicos como Pb, Cr e Hg. Uma possibilidade
é fazer uma mistura de dois resíduos para obter um
material que apresente as características necessárias
para o descarte. Considere que um laboratório disponha
de frascos de volumes iguais cheios dos resíduos,
listados no quadro.

Qual combinação de resíduos poderá ser descartada na
rede de esgotos?

Em 2014, iniciou-se em São Paulo uma séria
crise hídrica que também afetou o setor energético,
agravada pelo aumento do uso de ar-condicionado e
ventiladores. Com isso, intensifica-se a discussão sobre
a matriz energética adotada nas diversas regiões do
país. Sendo assim, há necessidade de se buscarem
fontes alternativas de energia renovável que impliquem
menores impactos ambientais.
Considerando essas informações, qual fonte poderia ser
utilizada?
O etanol é um combustível renovável obtido da
cana-de-açúcar e é menos poluente do que os
combustíveis fósseis, como a gasolina e o diesel. O etanol
tem densidade 0,8 g/cm3 , massa molar 46 g
mol
e calor de
combustão aproximado de −1 300 kJ/mol
. Com o grande
aumento da frota de veículos, tem sido incentivada a
produção de carros bicombustíveis econômicos, que
são capazes de render até 20 km/L em rodovias, para
diminuir a emissão de poluentes atmosféricos.
O valor correspondente à energia consumida para que
o motorista de um carro econômico, movido a álcool,
percorra 400 km na condição de máximo rendimento é
mais próximo de
O gás hidrogênio é considerado um ótimo
combustível — o único produto da combustão
desse gás é o vapor de água, como mostrado na
equação química.
2 H2 (g) + O2 (g) → 2 H2O (g)
Um cilindro contém 1 kg de hidrogênio e todo
esse gás foi queimado. Nessa reação, são rompidas e
formadas ligações químicas que envolvem as energias
listadas no quadro.

Massas molares ( g/mol
): H2 = 2; O2 = 32; H2O = 18.
Qual é a variação da entalpia, em quilojoule, da reação
de combustão do hidrogênio contido no cilindro?

Na busca por ouro, os garimpeiros se confundem
facilmente entre o ouro verdadeiro e o chamado ouro
de tolo, que tem em sua composição 90% de um
minério chamado pirita (FeS2). Apesar do engano, a
pirita não é descartada, pois é utilizada na produção do
ácido sulfúrico, que ocorre com rendimento global de
90%, conforme as equações químicas apresentadas.
Considere as massas molares: FeS2 (120 g/mol) , O2 32 g/mol), Fe2O3 ( 160 g/mol) , SO2 ( 64 g/mol), SO3 ( 80 g/mol) , H2O ( 18 g/mol ) , H2SO4 ( 98 g/mol ).
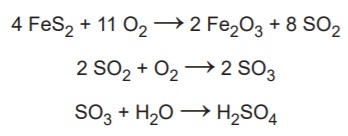
Qual é o valor mais próximo da massa de ácido sulfúrico,
em quilograma, que será produzida a partir de 2,0 kg de
ouro de tolo?
O 2-BHA é um fenol usado como antioxidante para
retardar a rancificação em alimentos e cosméticos que
contêm ácidos graxos insaturados. Esse composto
caracteriza-se por apresentar uma cadeia carbônica
aromática mononuclear, apresentando o grupo
substituinte terc-butil na posição orto e o grupo metóxi
na posição para.
A fórmula estrutural do fenol descrito é




