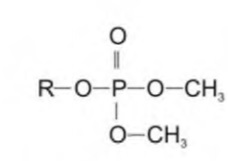
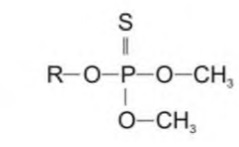
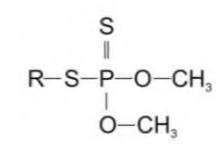
3db7c1ea-c1
ENEM 2010 - Química - Relações da Química com as Tecnologias, a Sociedade e o Meio Ambiente
O crescimento da produção de energia elétrica ao longo do tempo tem influenciado decisivamente o progresso da humanidade, mas também tem criado uma séria preocupação: o prejuízo ao meio ambiente. Nos próximos anos, uma nova tecnologia de geração de energia elétrica deverá ganhar espaço: as células a combustível hidrogênio/oxigênio.
Com base no texto e na figura, a produção de energia elétrica por meio da célula a combustível hidrogênio/ oxigênio diferencia-se dos processos convencionais porque
O crescimento da produção de energia elétrica ao longo do tempo tem influenciado decisivamente o progresso da humanidade, mas também tem criado uma séria preocupação: o prejuízo ao meio ambiente. Nos próximos anos, uma nova tecnologia de geração de energia elétrica deverá ganhar espaço: as células a combustível hidrogênio/oxigênio.
Com base no texto e na figura, a produção de energia elétrica por meio da célula a combustível hidrogênio/ oxigênio diferencia-se dos processos convencionais porque
Com base no texto e na figura, a produção de energia elétrica por meio da célula a combustível hidrogênio/ oxigênio diferencia-se dos processos convencionais porque

A
transforma energia química em energia elétrica, sem causar danos ao meio ambiente, porque o principal subproduto formado é a água.
B
converte a energia química contida nas moléculas dos componentes em energia térmica, sem que ocorra a produção de gases poluentes nocivos ao meio ambiente.
C
transforma energia química em energia elétrica, porém emite gases poluentes da mesma forma que a produção de energia a partir dos combustíveis fósseis.
D
converte energia elétrica proveniente dos combustíveis fósseis em energia química, retendo os gases poluentes produzidos no processo sem alterar a qualidade do meio ambiente.
E
converte a energia potencial acumulada nas moléculas de água contidas no sistema em energia química, sem que ocorra a produção de gases poluentes nocivos ao meio ambiente.


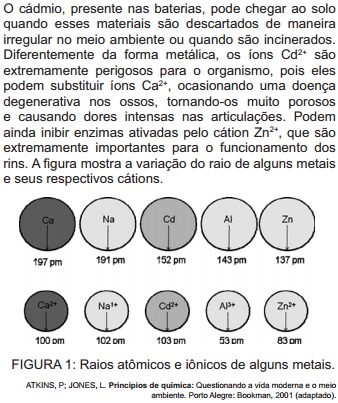
 pelo cátion do metal.
pelo cátion do metal. pelo cátion do metal.
pelo cátion do metal.