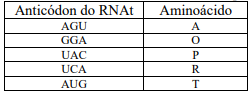
Analisando a charge e os efeitos da globalização no mundo atual, é possível concluir que:

Analisando a charge e os efeitos da globalização no mundo atual, é possível concluir que:

Analisando a charge e os efeitos da globalização no mundo atual, é possível concluir que:

Leia o texto a seguir para responder a questão.
“A política econômica ideal do capitalismo globalizado é o neoliberalismo. Os princípios do liberalismo clássico (século XVIII) desde Adam Smith podem ser resumidos em: 1- respeito ao direito à propriedade privada e ao lucro; 2- economia de mercado; 3- não intervenção do Estado na economia; 4- controle de preços através da livre concorrência.”
Adaptado de BRAICK, Patrícia Ramos. História: das cavernas ao terceiro milênio. 2.ed. São Paulo: Moderna, 2010.vol.3. p. 245.
Com o declínio das taxas de crescimento econômico e com a crise da economia global, os resultados da globalização são materializados de várias maneiras nos países do mundo.
Sobre os aspectos da globalização julgue os itens e marque o que estiver correto.

O uso de novas tecnologias em computação e em telecomunicações e as facilidades nos transportes têm contribuído para dinamizar ainda mais o sistema produtivo e financeiro em escala global.
Sobre essa temática julgue os itens e marque o que estiver correto.
Observe e interprete os gráficos que mostram duas tendências mundiais.

Analise as alternativas a seguir e marque aquela que descreve corretamente as tendências mostradas nos gráficos.

O gás hidrogênio é muito utilizado em diversos processos industriais, tais como: síntese de amônia, hidrogenação de óleos e gorduras, etc. Uma das formas utilizadas para a produção do gás hidrogênio é a partir da reação de reforma do metano. Este processo, em condições adequadas, ocorre através de duas reações representadas pelas equações 1 e 2, já a equação 3 representa a reação global deste processo.
Equação 1: CH4(g) + H2O(g) → CO(g) + 3H2(g) ∆ H = +206 kJ
Equação 2: CO(g) + H2O(g) → CO2(g) + H2(g) ∆ H = - 41 kJ
Equação 3: CH4(g) + 2H2O(v) → CO2(g) + 4H2(g)
Dados: Massas molares (g.mol-1): C = 12, H = 1, O = 16
Para produzir 500 gramas de H2 pela reação representada na equação 3, a quantidade de metano consumida
será igual a
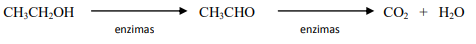
O gás hidrogênio é muito utilizado em diversos processos industriais, tais como: síntese de amônia, hidrogenação de óleos e gorduras, etc. Uma das formas utilizadas para a produção do gás hidrogênio é a partir da reação de reforma do metano. Este processo, em condições adequadas, ocorre através de duas reações representadas pelas equações 1 e 2, já a equação 3 representa a reação global deste processo.
Equação 1: CH4(g) + H2O(g) → CO(g) + 3H2(g) ∆ H = +206 kJ
Equação 2: CO(g) + H2O(g) → CO2(g) + H2(g) ∆ H = - 41 kJ
Equação 3: CH4(g) + 2H2O(v) → CO2(g) + 4H2(g)
Dados: Massas molares (g.mol-1): C = 12, H = 1, O = 16
Sobre as substâncias e as reações representadas por estas equações é incorreto afirmar que: