Doze pontos são assinalados sobre quatro segmentos de reta
de forma que três pontos sobre três segmentos distintos nunca
são colineares, como na figura.

O número de triângulos distintos que podem ser desenhados
com os vértices nos pontos assinalados é

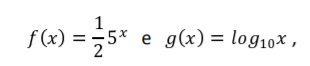

























 + H
+ H

