O rótulo de uma marca de água mineral indica as quantidades dos seguintes cátions de elementos alcalinos e
alcalinoterrosos: Na+ (1,955 mg L-1
); K+ (0,975 mg L-1
);
Mg2+ (0,480 mg L-1
); Ca2+ (2,680 mg L-1
).
Sabendo que o contraíon de todos esses cátions é o
Cl- , e, sendo esses os únicos sais cloretos dissolvidos,
a quantidade de Cl- , em mmol na água mineral é mais
próxima de
Dados
MNa = 23 g mol-1
MK = 39 g mol-1
MCa = 40 g mol-1
MMg = 24 g mol-1
O rótulo de uma marca de água mineral indica as quantidades dos seguintes cátions de elementos alcalinos e alcalinoterrosos: Na+ (1,955 mg L-1 ); K+ (0,975 mg L-1 ); Mg2+ (0,480 mg L-1 ); Ca2+ (2,680 mg L-1 ).
Sabendo que o contraíon de todos esses cátions é o Cl- , e, sendo esses os únicos sais cloretos dissolvidos, a quantidade de Cl- , em mmol na água mineral é mais próxima de
Dados
MNa = 23 g mol-1
MK = 39 g mol-1
MCa = 40 g mol-1
MMg = 24 g mol-1
Gabarito comentado
Esta questão aborda conceitos relacionados à concentração de íons em solução.
Para resolvê-la é preciso utilizar as massas molares dos cátions para calcular seus números de mols.
Sendo assim, observemos os dados e a resolução da questão:
Dados:
C (Na+) = 1,955 mg L-1 – M (Na+) = 23 g mol-1;
C (K+) = 0,975 mg L-1 – M (K+) = 39 g mol-1;
C (Mg2+) = 0,480 mg L-1 – M (Mg2+) = 24 g mol-1;
C (Ca2+) = 2,680 mg L-1 – M (Ca2+) = 40 g mol-1.
Resolução:
Com os valores das concentrações em g mol-1 e as massas molares dos cátions é possível calcular o número de mols dos cátions. Considerando 1 L de água, obtemos as massas dos cátions (m):
m (Na+) = 1,955 mg
m (K+) = 0,975 mg
m (Mg2+) = 0,480 mg
m (Ca2+) = 2,680 mg
Com as massas, podemos obter o número de mols (n), pois:
n = m/M
Em que M é a massa molar.
Assim, podemos substituir os dados. Considerando que as massas molares estão em g mol-1 também é preciso dividir por 1000 (conversão de mg para g):
n (Na+) = 1,955/(1000 × 23) = 8,5 × 10-5 mol
n (K+) = 0,975/(1000 × 39) = 2,5 × 10-5 mol
n (Mg2+) = 0,480/(1000 × 24) = 2,0 × 10-5 mol
n (Ca2+) = 2,680/(1000 × 40) = 6,7 × 10-5 mol
Com os
números de mols de cada cátion, precisamos saber a relação entre a quantidade
desses cátions e o ânion cloreto. De acordo com a dissolução dos sais formados
por esses cátions com o íon cloreto em água, temos que:
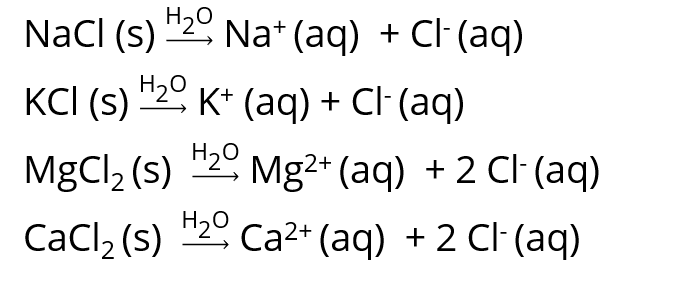
Assim, para cada mol de Na+ e K+, é necessário um mol de Cl-. Mas, para cada mol de Mg2+ e Ca2+ são necessários dois mols de Cl-. Logo, o número de mols de Cl- será igual ao número de mols de Na+ e K+, mas será duas vezes o valor do número de mols de Mg2+ e Ca2+. O número de mols total é dado por:
n (Cl-)
= 8,5 × 10-5 + 2,5 × 10-5 + 2 × 2,0 × 10-5 + 2 × 6,7 × 10-5 = 0,284 × 10-3 mol
O enunciado requer o número de mols em mmol, logo, basta multiplicar por 1000 (103):
n (Cl-)
= 0,284 mmol
Gabarito da Professora: Letra E.






