No preparo de certas massas culinárias, como pães, é
comum adicionar-se um fermento que, dependendo da
receita, pode ser o químico, composto principalmente por
hidrogenocarbonato de sódio (NaHCO3), ou o fermento
biológico, formado por leveduras. Os fermentos
adicionados, sob certas condições, são responsáveis pela
produção de dióxido de carbono, o que auxilia a massa a
crescer.
Para explicar a produção de dióxido de carbono, as seguintes
afirmações foram feitas.
I. Tanto o fermento químico quanto o biológico reagem
com os carboidratos presentes na massa culinária, sendo
o dióxido de carbono um dos produtos dessa reação.
II. O hidrogenocarbonato de sódio, presente no fermento
químico, pode se decompor com o aquecimento,
ocorrendo a formação de carbonato de sódio (Na2CO3),
água e dióxido de carbono.
III. As leveduras, que formam o fermento biológico,
metabolizam os carboidratos presentes na massa
culinária, produzindo, entre outras substâncias, o dióxido
de carbono.
IV. Para que ambos os fermentos produzam dióxido de
carbono, é necessário que a massa culinária seja
aquecida a temperaturas altas (cerca de 200 ºC),
alcançadas nos fornos domésticos e industriais.
Dessas afirmações, as que explicam corretamente a
produção de dióxido de carbono pela adição de fermento à
massa culinária são, apenas,
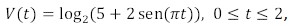
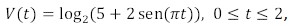
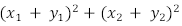 é igual a
é igual a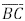 e
e 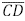 . Os segmentos
. Os segmentos 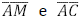 interceptam o segmento
interceptam o segmento 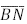 nos pontos
nos pontos 

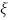 cuja parte imaginária é positiva. A parte real de
cuja parte imaginária é positiva. A parte real de 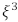 é igual a
é igual a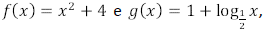 em que o domínio de
em que o domínio de 
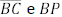 = 1. Os pontos R, S e T pertencem aos lados
= 1. Os pontos R, S e T pertencem aos lados 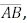
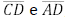 , respectivamente. O segmento
, respectivamente. O segmento 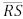 é paralelo a
é paralelo a 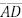 e intercepta
e intercepta 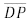 no ponto Q. O segmento
no ponto Q. O segmento 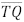 é paralelo a
é paralelo a 

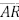 , o maior valor da soma das áreas do retângulo
, o maior valor da soma das áreas do retângulo 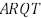 , do triângulo CQP e do triângulo DQS, para x variando no intervalo aberto ] 0,3[, é
, do triângulo CQP e do triângulo DQS, para x variando no intervalo aberto ] 0,3[, é























