298f03bc-ab
USP 2013 - Química - Sistemas Gasosos - Lei, Teoria Cinética, Equação e Mistura dos Gases. Princípio de Avogadro., Transformações Químicas
Qual recipiente contém a mesma quantidade de átomos que um recipiente selado de 22,4 L, contendo H2, mantido a 2 atm e 273 K?
Qual recipiente contém a mesma quantidade de átomos que um recipiente selado de 22,4 L, contendo H2, mantido a 2 atm e 273 K?
A tabela abaixo apresenta informações sobre cinco gases contidos em recipientes separados e selados.


A
1
B
2
C
3
D
4
E
5


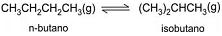













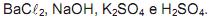





 e
e
 e
e

 sendo que 1 g de
sendo que 1 g de



 será extraído do
será extraído do  pela água, até que a concentração de
pela água, até que a concentração de em
em  se iguale a zero.
se iguale a zero. será extraído da água pelo
será extraído da água pelo  até que a concentração de
até que a concentração de em água se iguale a zero.
em água se iguale a zero. no
no tenderá a aumentar e a de
tenderá a aumentar e a de na água, tenderá a diminuir, até que se atinja um estado de equilíbrio.
na água, tenderá a diminuir, até que se atinja um estado de equilíbrio. na água tenderá a aumentar e a de
na água tenderá a aumentar e a de  no
no , tenderá a diminuir, até que se atinja um estado de equilíbrio.
, tenderá a diminuir, até que se atinja um estado de equilíbrio. nas duas fases.
nas duas fases.