(URCA/2022.2) Quantos estereoisômeros são possíveis
para o seguinte composto?
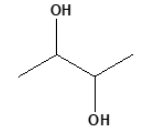


Considera-se
que quando uma pessoa ingere dois copos de água, seu suco gástrico (solução de ácido clorídrico, pH
igual a 1) dilui de 50 para 500 mL. Nessa condição o pH da solução restante
logo após a ingestão da água será de:
Um
hidróxido hipotético possui formulação M(OH)2. Com base nos conhecimentos
básicos de química, marque a opção que indica o elemento químico que poderia
substituir M na formulação em questão:
Conforme
estabelece a lei de Robert Boyle (1660), para proporcionar um aumento na
pressão de uma determinada amostra gasosa numa transformação isotérmica, é
necessário:
25
 CCl4(g) + HCl(g)
CCl4(g) + HCl(g)
 2 C2H5OH + 2 CO2
2 C2H5OH + 2 CO2O
alumínio é obtido pela eletrólise da bauxita. Nessa eletrólise, ocorre a
formação de oxigênio que reage com um dos eletrodos de carbono utilizados no
processo. A equação não balanceada que representa o processo global é:
 CO2 + Al
CO2 + Al Para 2
mols de Al2O3, quantos mols de CO2 e Al, respectivamente, são produzidos nesse
processo?
Regras
de solubilidade de substâncias consideram que uma substância polar tende a se
dissolver em outra polar. Com base nesta informação e considerando quantidades
apropriadas para a ocorrência do processo, indique como será a mistura
resultante após a adição de bromo (Br2) à mistura inicial de tetracloreto de
carbono (CCl4) e água (H2O):