18359ba0-28
UNIFESP 2005 - Química - Propriedades Coligativas: Tonoscopia, Ebulioscopia, Crioscopia e Pressão Osmótica., Soluções e Substâncias Inorgânicas
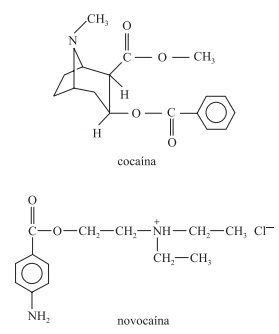
Na figura são apresentadas duas curvas que expressam a relação entre a pressão de vapor de dois líquidos, A e B, e a temperatura. Um deles é uma solução aquosa de sacarose 1,0 mol/L e o outro, água destilada.

Considerando-se o comportamento da pressão de vapor em relação à temperatura de um terceiro líquido, C, uma solução aquosa de nitrato de alumínio,  e das cur- vas A e B, são feitas as seguintes afirmações:
e das cur- vas A e B, são feitas as seguintes afirmações:
I. A curva da solução C deve se posicionar à esquerda da curva A.
II. A temperatura de ebulição do líquido A é menor que a temperatura de ebulição do líquido B.
III. A solução C dever apresentar maior pressão de vapor que o líquido B.
IV. O líquido A é água destilada.
É correto apenas o que se afirma em
Na figura são apresentadas duas curvas que expressam a relação entre a pressão de vapor de dois líquidos, A e B, e a temperatura. Um deles é uma solução aquosa de sacarose 1,0 mol/L e o outro, água destilada.

Considerando-se o comportamento da pressão de vapor em relação à temperatura de um terceiro líquido, C, uma solução aquosa de nitrato de alumínio, e das cur- vas A e B, são feitas as seguintes afirmações:
e das cur- vas A e B, são feitas as seguintes afirmações:
I. A curva da solução C deve se posicionar à esquerda da curva A.
II. A temperatura de ebulição do líquido A é menor que a temperatura de ebulição do líquido B.
III. A solução C dever apresentar maior pressão de vapor que o líquido B.
IV. O líquido A é água destilada.
É correto apenas o que se afirma em

Considerando-se o comportamento da pressão de vapor em relação à temperatura de um terceiro líquido, C, uma solução aquosa de nitrato de alumínio,
 e das cur- vas A e B, são feitas as seguintes afirmações:
e das cur- vas A e B, são feitas as seguintes afirmações:I. A curva da solução C deve se posicionar à esquerda da curva A.
II. A temperatura de ebulição do líquido A é menor que a temperatura de ebulição do líquido B.
III. A solução C dever apresentar maior pressão de vapor que o líquido B.
IV. O líquido A é água destilada.
É correto apenas o que se afirma em
A
I e III.
B
III e IV.
C
II e III.
D
II e IV.
E
I e IV.

 . A aplicação da nanotecnologia é bastante vasta: medicamentos programados para atingir um determi- nado alvo, janelas autolimpantes que dispensam o uso de pro- dutos de limpeza, tecidos com capacidade de suportar condições extremas de temperatura e impacto, são alguns exemplos de projetos de pesquisas que recebem vultuosos investimentos no mundo inteiro.Vidro autolimpante é aquele que recebe uma camada ultrafina de dióxido de titânio. Essa camada é aplicada no vidro na última etapa de sua fabricação. A espessura de uma camada ultrafina constituída somente por
. A aplicação da nanotecnologia é bastante vasta: medicamentos programados para atingir um determi- nado alvo, janelas autolimpantes que dispensam o uso de pro- dutos de limpeza, tecidos com capacidade de suportar condições extremas de temperatura e impacto, são alguns exemplos de projetos de pesquisas que recebem vultuosos investimentos no mundo inteiro.Vidro autolimpante é aquele que recebe uma camada ultrafina de dióxido de titânio. Essa camada é aplicada no vidro na última etapa de sua fabricação. A espessura de uma camada ultrafina constituída somente por  uniformemente distribuído, massa molar 80 g/mol edensidade
uniformemente distribuído, massa molar 80 g/mol edensidade  , depositada em uma janela com dimensões de 50 × 100 cm, que contém
, depositada em uma janela com dimensões de 50 × 100 cm, que contém tomos de titânio (constante de Avogadro =
tomos de titânio (constante de Avogadro =  ) é igual a
) é igual a



 para cada quilograma de álcool, será de
para cada quilograma de álcool, será de











 .
.
 . Considerando que reagente limitante é NaCl, o rendimento percentual desse processo, corretamente calculado pelo grupo de alunos, foi igual a
. Considerando que reagente limitante é NaCl, o rendimento percentual desse processo, corretamente calculado pelo grupo de alunos, foi igual a