
Um átomo pode emitir uma radiação alfa, 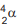 ou beta,
ou beta, 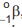 , e se
transformar em outro átomo, que, por sua vez, se desintegra
e se transforma em um terceiro e, assim, sucessivamente, até
a sequência chegar a um átomo estável. A sequência de
átomos é denominada série radioativa natural quando ocorre
de forma espontânea, na natureza com elementos radioativos.
A série do urânio 238, após decaimentes radioativos chega ao
chumbo 206,
, e se
transformar em outro átomo, que, por sua vez, se desintegra
e se transforma em um terceiro e, assim, sucessivamente, até
a sequência chegar a um átomo estável. A sequência de
átomos é denominada série radioativa natural quando ocorre
de forma espontânea, na natureza com elementos radioativos.
A série do urânio 238, após decaimentes radioativos chega ao
chumbo 206, 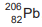 , átomo estável, como mostra a equação
nuclear global.
, átomo estável, como mostra a equação
nuclear global.
Considerando-se essas informações sobre a série radioativa
do urânio 238, é correto afirmar:

Um átomo pode emitir uma radiação alfa, 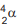 ou beta,
ou beta, 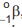 , e se
transformar em outro átomo, que, por sua vez, se desintegra
e se transforma em um terceiro e, assim, sucessivamente, até
a sequência chegar a um átomo estável. A sequência de
átomos é denominada série radioativa natural quando ocorre
de forma espontânea, na natureza com elementos radioativos.
A série do urânio 238, após decaimentes radioativos chega ao
chumbo 206,
, e se
transformar em outro átomo, que, por sua vez, se desintegra
e se transforma em um terceiro e, assim, sucessivamente, até
a sequência chegar a um átomo estável. A sequência de
átomos é denominada série radioativa natural quando ocorre
de forma espontânea, na natureza com elementos radioativos.
A série do urânio 238, após decaimentes radioativos chega ao
chumbo 206, 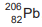 , átomo estável, como mostra a equação
nuclear global.
, átomo estável, como mostra a equação
nuclear global.
Considerando-se essas informações sobre a série radioativa
do urânio 238, é correto afirmar:
O rádio 226,  ao emitir uma partícula alfa, se
transforma em polônio 218,
ao emitir uma partícula alfa, se
transforma em polônio 218,  .
.
O bismuto 214,  , ao emitir uma partícula beta, se
transforma em polônio 210,
, ao emitir uma partícula beta, se
transforma em polônio 210,  .
.


