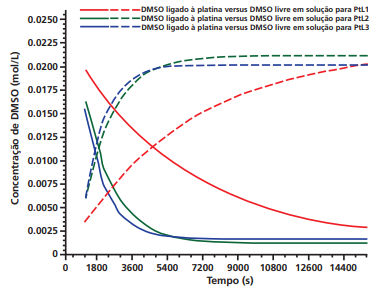
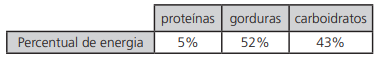
20c29d78-b7
UNICAMP 2024 - Química - Interações Atômicas: Ligações Iônicas, Ligações Covalentes e Ligações Metálicas. Ligas Metálicas., Química Orgânica, Substâncias e suas propriedades
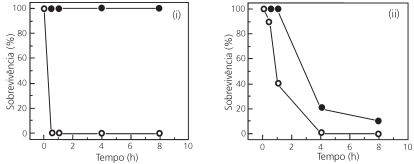
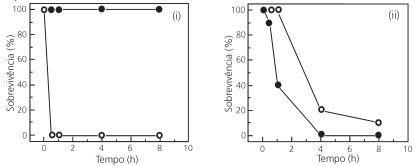
Os repelentes tópicos para a pele foram projetados para proteger – por contato ou à pequena distância – contra picadas
de insetos. Além desses, há os repelentes ditos “espaciais”,
compostos cuja ação repelente é garantida para distâncias um
pouco maiores. Um repelente espacial cria uma zona livre de
mosquitos causadores de arboviroses. Óleo de cravo, icaridina
e transflutrina foram então testados para a prevenção contra
fêmeas do mosquito Aedes aegypti, que são as responsáveis
pela transmissão dessas doenças. Os resultados desses testes
são mostrados na figura a seguir.
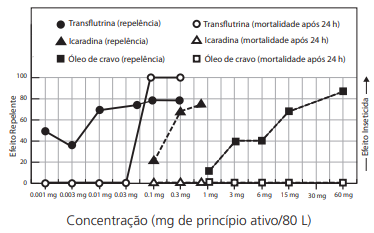
Com base nos resultados experimentais, é correto afirmar que,
na faixa considerada,
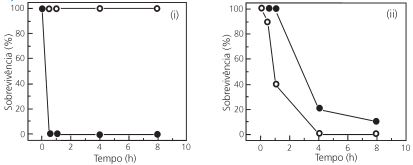
Os repelentes tópicos para a pele foram projetados para proteger – por contato ou à pequena distância – contra picadas
de insetos. Além desses, há os repelentes ditos “espaciais”,
compostos cuja ação repelente é garantida para distâncias um
pouco maiores. Um repelente espacial cria uma zona livre de
mosquitos causadores de arboviroses. Óleo de cravo, icaridina
e transflutrina foram então testados para a prevenção contra
fêmeas do mosquito Aedes aegypti, que são as responsáveis
pela transmissão dessas doenças. Os resultados desses testes
são mostrados na figura a seguir.

Com base nos resultados experimentais, é correto afirmar que,
na faixa considerada,
A
a transflutrina, a icaridina e o óleo de cravo têm ação repelente, mas não ação inseticida.
B
apenas a transflutrina e a icaridina têm ação repelente, mas
não ação inseticida.
C
a transflutrina, a icaridina e o óleo de cravo têm ação repelente, mas somente um deles tem ação inseticida.
D
apenas a transflutrina e a icaridina têm ação repelente, mas
somente uma delas tem ação inseticida.