Questõesde UNB sobre Química
A IA, em conjunto com a espectrofotometria UV-VIS, foi utilizada para estimar a concentração de amônia em soluções aquosas, por meio da complexação com íons cobalto (Co2+), formando o complexo [Co(NH3)6] 2+. O treino da IA é feito por meio da análise de amostras de água, com base nos dados de absorbância, aumentando-se o intervalo de detecção de forma eficiente. A reação entre o íon Co2+ e a amônia para formar o complexo [Co(NH3)6] 2+ pode ser representada pela equação a seguir, cuja constante de equilíbrio vale 1,3 × 105 .
Co2+ (aq) + 6 NH3 (aq) ⇌ [Co(NH3)6] 2+ (aq)
Considerando que a constante de Avogadro seja igual a 6,02 × 1023 mol−1, julgue o item.
O valor da constante de equilíbrio da reação em apreço
indica que a decomposição do complexo [Co(NH3)6]
2+ é
favorecida.
A IA, em conjunto com a espectrofotometria UV-VIS, foi
utilizada para estimar a concentração de amônia em soluções
aquosas, por meio da complexação com íons cobalto (Co2+),
formando o complexo [Co(NH3)6]
2+. O treino da IA é feito por
meio da análise de amostras de água, com base nos dados de
absorbância, aumentando-se o intervalo de detecção de forma
eficiente. A reação entre o íon Co2+ e a amônia para formar o
complexo [Co(NH3)6]
2+ pode ser representada pela equação a
seguir, cuja constante de equilíbrio vale 1,3 × 105
.
Co2+ (aq) + 6 NH3 (aq) ⇌ [Co(NH3)6]
2+ (aq)
Considerando que a constante de Avogadro seja igual a
6,02 × 1023 mol−1, julgue o item.
Considere que, para a preparação do complexo, seja utilizada
uma solução de cloreto de cobalto (II) anidro (CoCl2). Nesse
caso, a relação entre o produto de solubilidade (Kps) do
CoCl2 e sua solubilidade molar (cs) seriam corretamente
representados por 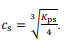
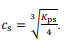
A partir das informações precedentes, julgue o item que se segue.
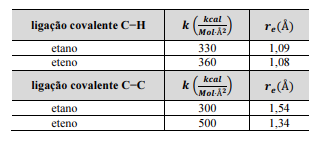
Para a ligação C−H esticada 0,02 Å além da sua distância de
equilíbrio, a energia potencial em um eteno será menor que
em um etano.
A partir das informações precedentes, julgue o item que se
segue.
Para a ligação C−C esticada 0,2 Å além de sua respectiva
distâncias de equilíbrio, a força de interação na ligação do
eteno é duas vezes mais intensa que na ligação do etano.
A partir das informações precedentes, julgue o item que se segue.
Para a ligação C−C esticada 0,2 Å além de sua respectiva distâncias de equilíbrio, a força de interação na ligação do eteno é duas vezes mais intensa que na ligação do etano.

Considerando as informações presentes no texto e na tabela precedentes, julgue o item que se segue.
A entalpia de vaporização caracteriza-se por ser sempre
positiva.

Considerando as informações presentes no texto e na tabela precedentes, julgue o item que se segue.
A entalpia de um sistema é uma grandeza, expressa em
unidade de energia, que informa a quantidade de energia
desse sistema que poderia ser transformada em calor em um
processo a pressão constante.

Considerando as informações presentes no texto e na tabela precedentes, julgue o item que se segue.
A reação de combustão do gás hidrogênio gera água na
forma de vapor; se a reação gerasse água na forma líquida, a
liberação de energia seria a mesma.

Considerando as informações presentes no texto e na tabela precedentes, julgue o item que se segue.
Reações de combustão são facilmente reversíveis.

Considerando as informações presentes no texto e na tabela precedentes, julgue o item que se segue.
A entalpia-padrão de formação (ΔHºf) é nula para
substâncias simples, desde que estejam no estado-padrão, no
estado físico e na forma alotrópica mais estáveis.

Considerando as informações presentes no texto e na tabela precedentes, julgue o item que se segue.
A reação de combustão do gás hidrogênio libera uma
quantidade de energia superior a 230 kJ/mol.

Considerando as informações presentes no texto e na tabela
precedentes, julgue o item que se segue.
A entalpia-padrão de combustão (ΔHºc) pode ser chamada,
também, de calor de combustão.

Tendo como referência essas informações, julgue o item seguinte.
Quando o cálcio-41 captura um elétron, é formado o
nuclídeo 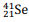 .
.
Tendo como referência essas informações, julgue o item seguinte.
Quando o cálcio-41 captura um elétron, é formado o
nuclídeo 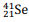 .
.


Tendo como referência essas informações, julgue o item seguinte.
A espécie formada pela ionização do átomo de cálcio possui
raio menor que o do átomo neutro de Ca.
Tendo como referência essas informações, julgue o item seguinte.
A espécie formada pela ionização do átomo de cálcio possui
raio menor que o do átomo neutro de Ca.


Tendo como referência essas informações, julgue o item seguinte.
Os íons K+
e Cl−
são isótopos entre si.
Tendo como referência essas informações, julgue o item seguinte.
Os íons K+
e Cl−
são isótopos entre si.


Tendo como referência essas informações e considerando que MA = 4MB, julgue o item.
Nas condições do experimento de Graham, em um tubo de
comprimento igual a 90 cm, o gás B percorrerá uma
distância y superior a 50 cm.
Tendo como referência essas informações e considerando que MA = 4MB, julgue o item.
Nas condições do experimento de Graham, em um tubo de
comprimento igual a 90 cm, o gás B percorrerá uma
distância y superior a 50 cm.
Em um experimento realizado por Thomas Graham, dois gases A e B foram liberados simultaneamente nas extremidades de um tubo de vidro; esses gases difundiram-se em direção ao centro do tubo e, no instante em que se encontraram, formaram um anel de um composto AB, como mostra a figura a seguir.
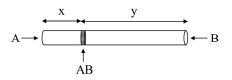
Para esses gases A e B, de massas molares MA e MB, respectivamente, verifica-se o seguinte postulado de Graham, em que vB representa a velocidade de difusão de B e vA, a velocidade de difusão de A.
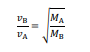
Tendo como referência essas informações e considerando que
MA = 4MB, julgue o item.
Considere que o gás cloreto de hidrogênio (HCl) possa
ser obtido a partir dos gases hidrogênio (H2) e cloro (Cl2)
por meio da reação reversível H2(g) + Cl2(g) ⇌ 2 HCl(g) e que
um frasco fechado, a uma dada temperatura, contenha
esses três gases em equilíbrio, com 20% de H2 e 60% de
Cl2 em volume, a uma pressão total de 10 atm. Nessas
condições, a constante de equilíbrio, no que se refere à
pressão, é superior a 0,25.
Tendo como referência essas informações e considerando que MA = 4MB, julgue o item.
Considere que o gás cloreto de hidrogênio (HCl) possa
ser obtido a partir dos gases hidrogênio (H2) e cloro (Cl2)
por meio da reação reversível H2(g) + Cl2(g) ⇌ 2 HCl(g) e que
um frasco fechado, a uma dada temperatura, contenha
esses três gases em equilíbrio, com 20% de H2 e 60% de
Cl2 em volume, a uma pressão total de 10 atm. Nessas
condições, a constante de equilíbrio, no que se refere à
pressão, é superior a 0,25.
Em um experimento realizado por Thomas Graham, dois gases A e B foram liberados simultaneamente nas extremidades de um tubo de vidro; esses gases difundiram-se em direção ao centro do tubo e, no instante em que se encontraram, formaram um anel de um composto AB, como mostra a figura a seguir.

Para esses gases A e B, de massas molares MA e MB, respectivamente, verifica-se o seguinte postulado de Graham, em que vB representa a velocidade de difusão de B e vA, a velocidade de difusão de A.
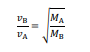
Considerando as informações anteriores, julgue o item.
Para produzir 63,5 milhões de quilogramas de ácido cítrico,
a quantidade de sacarose necessária será
igual ou superior a 50 milhões de quilogramas e inferior
a 60 milhões de quilogramas.
Considerando as informações anteriores, julgue o item.
Para produzir 63,5 milhões de quilogramas de ácido cítrico, a quantidade de sacarose necessária será
igual ou superior a 50 milhões de quilogramas e inferior
a 60 milhões de quilogramas.
A produção mundial de ácido cítrico é de aproximadamente 63,5 milhões de quilogramas por ano, sendo esse ácido orgânico produzido pela fermentação aeróbica da sacarose (C12H22O11) por uma cultura pura do fungo filamentoso Aspergillus niger, de acordo com a reação global representada a seguir.
C12H22O11 + 3 O2 → 2 C6H8O7 + 3 H2O
Considerando as informações anteriores, julgue o item.
Sabendo que a reação em tela tem a sua velocidade
aumentada na presença da enzima invertase extracelular, é
correto inferir que essa enzima funciona como catalisador de
uma das etapas da fermentação da sacarose realizada pelo
Aspergillus niger.
Considerando as informações anteriores, julgue o item.
Sabendo que a reação em tela tem a sua velocidade
aumentada na presença da enzima invertase extracelular, é
correto inferir que essa enzima funciona como catalisador de
uma das etapas da fermentação da sacarose realizada pelo
Aspergillus niger.
A produção mundial de ácido cítrico é de aproximadamente 63,5 milhões de quilogramas por ano, sendo esse ácido orgânico produzido pela fermentação aeróbica da sacarose (C12H22O11) por uma cultura pura do fungo filamentoso Aspergillus niger, de acordo com a reação global representada a seguir.
C12H22O11 + 3 O2 → 2 C6H8O7 + 3 H2O
Considerando as informações anteriores, julgue o item.
Caso a reação em apreço seja reversível e esteja sujeita às
leis do equilíbrio químico, um ambiente anaeróbico
favoreceria a produção de ácido cítrico.
Considerando as informações anteriores, julgue o item.
Caso a reação em apreço seja reversível e esteja sujeita às
leis do equilíbrio químico, um ambiente anaeróbico
favoreceria a produção de ácido cítrico.
A produção mundial de ácido cítrico é de aproximadamente 63,5 milhões de quilogramas por ano, sendo esse ácido orgânico produzido pela fermentação aeróbica da sacarose (C12H22O11) por uma cultura pura do fungo filamentoso Aspergillus niger, de acordo com a reação global representada a seguir.
C12H22O11 + 3 O2 → 2 C6H8O7 + 3 H2O