4d1cc375-47
UFF 2010 - Química - Grandezas: massa, volume, mol, massa molar, constante de Avogadro e Estequiometria., Soluções e Substâncias Inorgânicas, Substâncias Inorgânicas e suas características: Ácidos, Bases, Sais e Óxidos. Reações de Neutralização., Representação das transformações químicas
Uma carreta especial para transporte de substâncias corrosivas tombou na descida da Serra das Araras. Como consequência desse acidente, houve derramamento de ácido sulfúrico. Sabe-se que esse ácido é neutralizado com CaO.
Considerando que a concentração do ácido derramado é de 98,00 % peso por peso e sua densidade é de 1,84 g/mL, calcule a massa aproximada de CaO necessária para neutralizar 1000 L do ácido derramado.
Uma carreta especial para transporte de substâncias corrosivas tombou na descida da Serra das Araras. Como consequência desse acidente, houve derramamento de ácido sulfúrico. Sabe-se que esse ácido é neutralizado com CaO.
Considerando que a concentração do ácido derramado é de 98,00 % peso por peso e sua densidade é de 1,84 g/mL, calcule a massa aproximada de CaO necessária para neutralizar 1000 L do ácido derramado.
Considerando que a concentração do ácido derramado é de 98,00 % peso por peso e sua densidade é de 1,84 g/mL, calcule a massa aproximada de CaO necessária para neutralizar 1000 L do ácido derramado.
A
1,0 ton
B
1,0 kg
C
10,0 ton
D
10,0 kg
E
0,5 ton



 0,20 M (Kps do AgCl = 1,0x10-10 ), pode-se afirmar que
0,20 M (Kps do AgCl = 1,0x10-10 ), pode-se afirmar que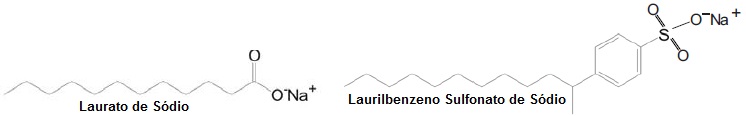





 produzem 18 g de
produzem 18 g de 

 em meio aquoso.
em meio aquoso.
 origina uma solução de pH acima de 7,00;
origina uma solução de pH acima de 7,00; 
