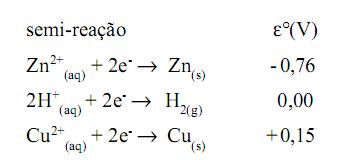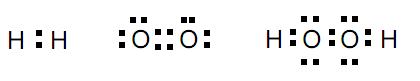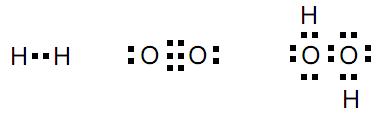cc8cdb2a-70
UEPB 2007 - Química - Relações da Química com as Tecnologias, a Sociedade e o Meio Ambiente
O sabor da água fornecida pela CAGEPA em Campina Grande difere do de João Pessoa, assim como, também, há diferença de sabor na água mineral que compramos em estabelecimentos comerciais, comparando-se diferentes marcas. Com base na informação apresentada acima, assinale o item que contém a explicação mais adequada sobre o sabor das águas.
O sabor da água fornecida pela CAGEPA em Campina Grande difere do de João Pessoa, assim como, também, há diferença de sabor na água mineral que compramos em estabelecimentos comerciais, comparando-se diferentes marcas. Com base na informação apresentada acima, assinale o item que contém a explicação mais adequada sobre o sabor das águas.
A
A explicação para a questão citada no texto se dá pela diferença nas condições climáticas características de cada região. Por exemplo, em regiões de chuvas torrenciais, como o sertão paraibano, os raios ionizam algumas moléculas de água produzindo as espécies químicas H3 O+ e OH- . A diferença na concentração dessas espécies nas águas que bebemos é o que explica tudo.
B
É quimicamente incorreto chamar essas misturas que bebemos diariamente de substância água. Trata-se de soluções, ou seja, misturas homogêneas nas quais a substância mais abundante é a água (H2 O). A diferença de sabor, citada no texto acima, se explica pelas diferenças de natureza e concentração das espécies químicas dissolvidas nessas misturas.
C
A diferença de sabor citada se explica pelas variações nas condições de pressão e temperatura características de cada local. Assim, em Campina Grande, por ser uma região alta e com clima frio, as condições energéticas favorecem a formação de ligações de hidrogênio mais fracas, isso em relação a locais quentes e no nível do mar como João Pessoa. As variações na intensidade das forças das ligações de hidrogênio é que explicam as diferenças de sabor dessas águas.
D
As condições magnéticas, que mudam de acordo com a posição geográfica de cada local, e de altitude têm significativa influência na polaridade das moléculas de água. Portanto, a explicação para a diferença de sabor dessas águas é que elas têm polaridades significativamente diferentes.
E
Não existe diferença na composição química das águas citadas no texto. A diferença de fato é cultural: o campinense gosta de uma coisa, o sertanejo de outra, e devemos respeitar isso. Na verdade essas diferenças de costumes e valores são tão marcantes que resultam em modificações genéticas e biológicas dos indivíduos. Assim, para uma mesma substância, o sabor que um individuo de João Pessoa percebe difere do gosto sentido por um sertanejo.









 Al2(CO3)3 + 6 H2O
Al2(CO3)3 + 6 H2O Al3SO4 + H2O
Al3SO4 + H2O Al2(SO4)3 + 6 H2O
Al2(SO4)3 + 6 H2O AlCl3 + H2O
AlCl3 + H2O AlCl3 + 3 H2O
AlCl3 + 3 H2O