2721f586-a5
UECE 2011 - Química - Cinética Química, Velocidade de Reação, Energia de Ativação, Concentração, Pressão, Temperatura e Catalisador, Soluções e Substâncias Inorgânicas, Substâncias Inorgânicas e suas características: Ácidos, Bases, Sais e Óxidos. Reações de Neutralização.
A queima de combustíveis fósseis nos veículos automotores produz uma infinidade de substâncias causadoras do efeito estufa, da chuva ácida e de danos irreparáveis aos ciclos biogeoquímicos do planeta. Contudo, esses efeitos podem ser minimizados por catálise. Sobre catálise e conversores catalíticos automotivos leia as frases abaixo, assinale com V, as verdadeiras e com F, as falsas.
( ) O processo que ocorre no cano de descarga dos veículos automotivos é uma catálise homogênea.
( ) Óxidos de nitrogênio, oriundos das descargas dos veículos, são responsáveis pela névoa fotoquímica.
( ) O conversor catalítico oxida o CO e hidrocarbonetos não queimados, transformando-os em dióxido de carbono e água.
( ) O conversor catalítico reduz os óxidos de nitrogênio a nitrogênio gasoso.
( ) Os conversores catalíticos eliminam totalmente a poluição atmosférica causada pelos gases liberados na descarga dos veículos automotivos.
A sequência correta, de cima para baixo, é
A queima de combustíveis fósseis nos veículos automotores produz uma infinidade de substâncias causadoras do efeito estufa, da chuva ácida e de danos irreparáveis aos ciclos biogeoquímicos do planeta. Contudo, esses efeitos podem ser minimizados por catálise. Sobre catálise e conversores catalíticos automotivos leia as frases abaixo, assinale com V, as verdadeiras e com F, as falsas.
( ) O processo que ocorre no cano de descarga dos veículos automotivos é uma catálise homogênea.
( ) Óxidos de nitrogênio, oriundos das descargas dos veículos, são responsáveis pela névoa fotoquímica.
( ) O conversor catalítico oxida o CO e hidrocarbonetos não queimados, transformando-os em dióxido de carbono e água.
( ) O conversor catalítico reduz os óxidos de nitrogênio a nitrogênio gasoso.
( ) Os conversores catalíticos eliminam totalmente a poluição atmosférica causada pelos gases liberados na descarga dos veículos automotivos.
A sequência correta, de cima para baixo, é
( ) O processo que ocorre no cano de descarga dos veículos automotivos é uma catálise homogênea.
( ) Óxidos de nitrogênio, oriundos das descargas dos veículos, são responsáveis pela névoa fotoquímica.
( ) O conversor catalítico oxida o CO e hidrocarbonetos não queimados, transformando-os em dióxido de carbono e água.
( ) O conversor catalítico reduz os óxidos de nitrogênio a nitrogênio gasoso.
( ) Os conversores catalíticos eliminam totalmente a poluição atmosférica causada pelos gases liberados na descarga dos veículos automotivos.
A sequência correta, de cima para baixo, é
A
V, F, F, F, V.
B
V, F, V, F, V.
C
F, V, V, V, F.
D
F, V, F, V, F.

 . Para não ficarem com esse odor, os cozinheiros lavam as mãos com limão. A reação química que ocorre é:
. Para não ficarem com esse odor, os cozinheiros lavam as mãos com limão. A reação química que ocorre é: 
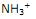 é um ácido de Brönsted.
é um ácido de Brönsted.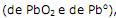 , mantidos em solução de
, mantidos em solução de 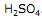 . A equação correspondente à reação envolvida na geração de energia é:
. A equação correspondente à reação envolvida na geração de energia é: 
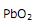 atuam como agentes redutores.
atuam como agentes redutores.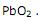 .
.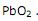 é +2.
é +2.