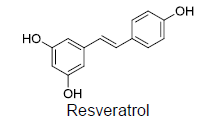
Um químico que trabalha em um laboratório de pesquisa recebeu a estrutura molecular de
alguns polímeros como demonstrados abaixo:



Após analisar as estruturas dessas substâncias, o químico concluiu que os polímeros
I, II e III são solúveis, respectivamente, nos seguintes solventes:
Um químico que trabalha em um laboratório de pesquisa recebeu a estrutura molecular de alguns polímeros como demonstrados abaixo:



Após analisar as estruturas dessas substâncias, o químico concluiu que os polímeros
I, II e III são solúveis, respectivamente, nos seguintes solventes: