4b5245cd-e3
UCPEL 2017 - Química - Transformações Químicas e Energia, Eletroquímica: Oxirredução, Potenciais Padrão de Redução, Pilha, Eletrólise e Leis de Faraday.
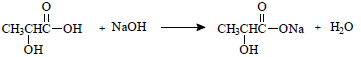
Os marca-passos cardíacos se utilizam de pilhas de
lítio que são bastante leves, seguras e de boa
durabilidade. São feitas de lítio e iodo que
apresentam os seguintes potenciais de redução,
respectivamente: - 3,04V e +0,54V. De acordo com
essas informações, sobre essa pilha é correto afirmar
que
Os marca-passos cardíacos se utilizam de pilhas de
lítio que são bastante leves, seguras e de boa
durabilidade. São feitas de lítio e iodo que
apresentam os seguintes potenciais de redução,
respectivamente: - 3,04V e +0,54V. De acordo com
essas informações, sobre essa pilha é correto afirmar
que
A
apresenta uma diferença de potencial de 2,50 V.
B
o lítio age como agente oxidante e é o polo
negativo.
C
o lítio é o ânodo pois sofre redução.
D
os elétrons migram do iodo para o lítio.
E
o iodo é o cátodo e polo positivo.




 (clonazepam) é um dos medicamentos
controlados mais consumidos no Brasil. Possui
propriedades farmacológicas comuns aos
benzodiazepínicos, sendo utilizado como ansiolítico
geral, sedativo, em transtornos de humor, entre
outros. Com relação à sua estrutura química, podese afirmar o seguinte:
(clonazepam) é um dos medicamentos
controlados mais consumidos no Brasil. Possui
propriedades farmacológicas comuns aos
benzodiazepínicos, sendo utilizado como ansiolítico
geral, sedativo, em transtornos de humor, entre
outros. Com relação à sua estrutura química, podese afirmar o seguinte: