Num processo de fissão nuclear, um nêutron colidiu com
o núcleo de um isótopo do urânio levando à formação de
dois núcleos menores e liberação de nêutrons que produziram
reações em cadeia com liberação de grande quantidade
de energia. Uma das possíveis reações nucleares
nesse processo é representada por:

O produto X, formado na fissão nuclear indicada acima, é
um isótopo do elemento químico:
Num processo de fissão nuclear, um nêutron colidiu com o núcleo de um isótopo do urânio levando à formação de dois núcleos menores e liberação de nêutrons que produziram reações em cadeia com liberação de grande quantidade de energia. Uma das possíveis reações nucleares nesse processo é representada por:

O produto X, formado na fissão nuclear indicada acima, é
um isótopo do elemento químico:
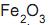 e impurezas. Ao se misturar 4,0 g de uma amostra deste minério com ácido clorídrico concentrado, obtêm- se 6,5 g de cloreto de ferro III. A porcentagem em massa de
e impurezas. Ao se misturar 4,0 g de uma amostra deste minério com ácido clorídrico concentrado, obtêm- se 6,5 g de cloreto de ferro III. A porcentagem em massa de 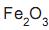 no minério é igual a
no minério é igual a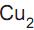 e CuO) se forma na superfície dos tachos, podendo se desprender e ser incorporado ao doce.
e CuO) se forma na superfície dos tachos, podendo se desprender e ser incorporado ao doce.  e no CuO são respectivamente 4+ e 2+.
e no CuO são respectivamente 4+ e 2+. é isóbaro do CuO.
é isóbaro do CuO.