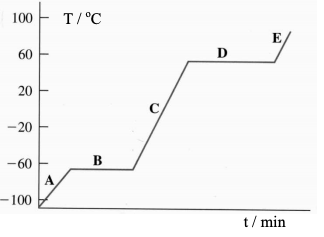
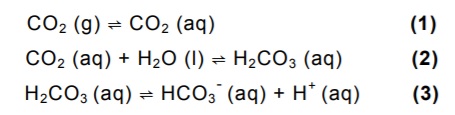O gráfico abaixo representa a temperatura de uma amostra, inicialmente no estado sólido, em
função da quantidade de calor absorvida.
Analise as proposições em relação aos números, indicados no gráfico, referentes aos estados
físicos da matéria e às suas características.
I. No estado líquido a substância assume a forma do recipiente que o contém. No gráfico,
esse estado está representado pelo número 3.
II. O número 2 representa mudança de estado físico, conhecida como sublimação.
III. Uma das características do estado gasoso é que as partículas que formam a matéria estão
bastante afastadas, dispersas no espaço. Devido a isso, nesse estado físico a matéria
pode ter a forma e o volume variáveis. No gráfico, este estado físico está representado
pelo número 5.
IV. O número 1 representa o estado sólido, que é caracterizado por a substância apresentar
volume e forma fixos. Para a amostra em questão, o estado sólido é predominante até a
temperatura de 350 K.
V. A ebulição está representada pelo número 4, e este processo é caracterizado pela
passagem do estado líquido para o sólido.
Assinale a alternativa correta.