Questõesde UEG sobre Termoquímica: Energia Calorífica, Calor de reação, Entalpia, Equações e Lei de Hess.
No gráfico a seguir, é apresentada a variação da energia durante uma reação química hipotética.
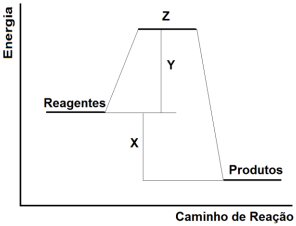
Com base no gráfico, pode-se correlacionar X, Y e Z, respectivamente, como
No gráfico a seguir, é apresentada a variação da energia durante uma reação química hipotética.

Com base no gráfico, pode-se correlacionar X, Y e Z, respectivamente, como
No gráfico a seguir, é apresentada a variação da energia durante uma reação química hipotética.

Com base no gráfico, pode-se correlacionar X, Y e Z, respectivamente, como

O metano (CH4) é um gás incolor e inodoro, pertencente à família dos alcanos. É também chamado de “gás dos
pântanos”, visto que se forma a partir da fermentação anaeróbica (sem oxigênio). A síntese do metano pode ser
representada a partir da reação entre o carbono na forma de grafite (C(graf)) e o gás hidrogênio (H2(g)), conforme a
equação mostrada a seguir.
C(graf) + 2H2(g) → CH4(g)
As reações envolvidas neste processo encontram-se representadas da seguinte forma:
CH4(g) + 2O2(g) → CO2(g) + 2H2O(l) ∆H° = -890,4 kJ/molC(graf) + O2(g) → CO2(g) ∆H° = -393,5 kJ/molH2(g) + 1 O2(g)/2 → H2O(l) ∆H° = 285,8 kJ/mol
Com base nessas reações, verifica-se que o valor da entalpia padrão de formação do CH4(g) é:
O álcool etílico combustível, mais popularmente conhecido como etanol, é uma fonte de energia limpa e renovável,
proveniente de várias matérias-primas como beterraba, milho e cana-de-açúcar, sendo esta última o insumo
agrícola mais utilizado na produção de etanol no Brasil.
Ao contrário dos combustíveis fósseis, o etanol é uma fonte de energia natural e limpa, pois sua composição não
contém poluentes que sejam prejudiciais à saúde e ao meio ambiente. Desde o momento em que brota no campo,
a cana-de-açúcar passa a absorver parte do gás carbônico utilizado na produção e no consumo do etanol.
A crescente fabricação brasileira de carros flex (movidos a gasolina e etanol), iniciada em 2003, foi o que permitiu o
avanço da utilização do etanol no Brasil. Atualmente, 97,7% dos carros produzidos no país podem ser abastecidos
com etanol ou gasolina, puros ou misturados em qualquer proporção.
A equação química que representa o processo de combustão do etanol encontra-se mostrada a seguir.
C2H6O(l) + 3O2(g) → 2CO2(g) + 3H2O(l)
Sabendo-se que a entalpia de formação da H2O(l) é -286 kJ/mol; que a do CO2(g) é - 393,5 kJ/mol e que a do
C2H6O(l) é - 277,6 kJ/mol, verifica-se que a energia liberada na combustão de 1,0 mol de etanol é:
O álcool etílico combustível, mais popularmente conhecido como etanol, é uma fonte de energia limpa e renovável, proveniente de várias matérias-primas como beterraba, milho e cana-de-açúcar, sendo esta última o insumo agrícola mais utilizado na produção de etanol no Brasil.
Ao contrário dos combustíveis fósseis, o etanol é uma fonte de energia natural e limpa, pois sua composição não contém poluentes que sejam prejudiciais à saúde e ao meio ambiente. Desde o momento em que brota no campo, a cana-de-açúcar passa a absorver parte do gás carbônico utilizado na produção e no consumo do etanol.
A crescente fabricação brasileira de carros flex (movidos a gasolina e etanol), iniciada em 2003, foi o que permitiu o avanço da utilização do etanol no Brasil. Atualmente, 97,7% dos carros produzidos no país podem ser abastecidos com etanol ou gasolina, puros ou misturados em qualquer proporção.
A equação química que representa o processo de combustão do etanol encontra-se mostrada a seguir.
C2H6O(l) + 3O2(g) → 2CO2(g) + 3H2O(l)
Sabendo-se que a entalpia de formação da H2O(l) é -286 kJ/mol; que a do CO2(g) é - 393,5 kJ/mol e que a do C2H6O(l) é - 277,6 kJ/mol, verifica-se que a energia liberada na combustão de 1,0 mol de etanol é:
O biodiesel é um biocombustível, ou seja, é derivado de fontes renováveis, e pode substituir parcial ou totalmente
os combustíveis derivados do petróleo. Reações químicas entre lipídios e álcoois de cadeia curta produzem os
ésteres de ácidos graxos constituintes do biodiesel. Um dos componentes do biodiesel produzido usando óleo de
soja e metanol é o éster metílico do ácido linoleico, cuja fórmula molecular é C19H34O2. Na combustão de 300
mols de C19H34O2, a quantidade de CO2 formada será:
As equações termoquímicas abaixo representam etapas de alguma forma relacionadas com a formação do cloreto de sódio.

Sobre esse assunto, é CORRETO afirmar:

Sobre esse assunto, é CORRETO afirmar:

