f5d936d9-e3
UCPEL 2018 - Química - Soluções: características, tipos de concentração, diluição, mistura, titulação e soluções coloidais., Soluções e Substâncias Inorgânicas
O leite, um dos principais alimentos que fazem
parte da rotina dos consumidores, foi alvo de
adulteração nas indústrias de laticínio. O produto
vencido era misturado a soda cáustica,
bicarbonato de sódio e água com o objetivo de
neutralizar a acidez e eliminar micro-organismos.
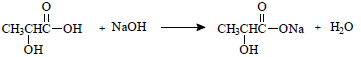
Considerando uma concentração de 1,5 g L-1 de
ácido láctico [CH3-CH(OH)-COOH]
em um lote de 200L de leite. Qual é o volume
aproximado necessário de solução de hidróxido
de sódio 0,5 mol L-1 necessário para neutralizar
todo o ácido láctico contido no lote?
O leite, um dos principais alimentos que fazem
parte da rotina dos consumidores, foi alvo de
adulteração nas indústrias de laticínio. O produto
vencido era misturado a soda cáustica,
bicarbonato de sódio e água com o objetivo de
neutralizar a acidez e eliminar micro-organismos.
Considerando uma concentração de 1,5 g L-1 de
ácido láctico [CH3-CH(OH)-COOH]
em um lote de 200L de leite. Qual é o volume
aproximado necessário de solução de hidróxido
de sódio 0,5 mol L-1 necessário para neutralizar
todo o ácido láctico contido no lote?
A
13,3 L
B
3,3 L
C
100 L
D
12,5 L
E
6,7 L