Questõesde PUC - RJ sobre Representação das transformações químicas
O silicato de sódio (Na2SiO3) utilizado na composição do cimento, pode ser obtido através de um
processo de calcinação (em elevada temperatura) da sílica (SiO2) com carbonato de sódio (Na2CO3), de
acordo com a equação química balanceada, representada a seguir: SiO2(g) + Na2CO3(s)
 Na2SiO3(s) + CO2(g)
Na2SiO3(s) + CO2(g)
Dados:
M(SiO2) = 60 g mol-1
M(Na2SiO3) = 122 g mol-1
Considerando que o rendimento desse processo foi de 70%, a massa, em kg, de Na2SiO3 formada a partir
de 9 kg de sílica foi de aproximadamente

 Na2SiO3(s) + CO2(g)
Na2SiO3(s) + CO2(g)
O iodeto de potássio (KI) é um sólido branco que pode
ser utilizado na formulação de xaropes mucolíticos e
expectorantes.
A porcentagem, em massa, de iodo na unidade formal de
iodeto de potássio é


A redução de grandes quantidades de dióxido de silício é
um processo industrial importante descrito pela equação
química abaixo.
SiO2(s) + C(s) → Si(s) + CO2(g)
Considerando a reação completa, a massa de silício, em
gramas, formada pela reação de 24.000 g de SiO2
com
excesso de carbono é










As nanopartículas de prata, usadas em diversas aplicações tecnológicas, podem ser preparadas, em solução
aquosa, pela redução de íons Ag+ usando boro-hidreto de sódio (NaBH4), como indicado na equação abaixo:
AgNO3 (aq) + NaBH4 (aq) → Ag (s) + ½ H2 (g) + ½ B2H6 (g) + NaNO3 (aq)
A partir de 100,00 mL de uma solução 2,0 × 10-3 mol L-1 de AgNO3, qual seria a massa mínima de NaBH4
necessária para a reação completa de Ag+ para Ag, expressa em gramas?
Dados:
M(AgNO3) = 170 g mol-1
M(Ag) = 108 g mol-1
M(NaBH4) = 38 g mol-1
As nanopartículas de prata, usadas em diversas aplicações tecnológicas, podem ser preparadas, em solução aquosa, pela redução de íons Ag+ usando boro-hidreto de sódio (NaBH4), como indicado na equação abaixo:
AgNO3 (aq) + NaBH4 (aq) → Ag (s) + ½ H2 (g) + ½ B2H6 (g) + NaNO3 (aq)
A partir de 100,00 mL de uma solução 2,0 × 10-3 mol L-1 de AgNO3, qual seria a massa mínima de NaBH4 necessária para a reação completa de Ag+ para Ag, expressa em gramas?
Dados:
M(AgNO3) = 170 g mol-1
M(Ag) = 108 g mol-1
M(NaBH4) = 38 g mol-1
O ácido tereftálico é um diácido carboxílico com fórmula
molecular C8H6O4
, muito utilizado na produção de poliéster
do tipo PET (polietilenotereftalato).
O percentual mais aproximado em massa de carbono, hidrogênio e oxigênio no ácido tereftálico é:
Dados
MC = 12 g mol-1
MH = 1 g mol-1
MO = 16 g mol-1
O ácido tereftálico é um diácido carboxílico com fórmula molecular C8H6O4 , muito utilizado na produção de poliéster do tipo PET (polietilenotereftalato).
O percentual mais aproximado em massa de carbono, hidrogênio e oxigênio no ácido tereftálico é:
Dados
MC = 12 g mol-1
MH = 1 g mol-1
MO = 16 g mol-1
Um comprimido efervescente de vitamina C contém
500 mg de ácido ascórbico (C6H8O6
). Quando um paciente bebe água em que foram dissolvidos dois comprimidos
de vitamina C, ele consumiu um número mais próximo de
moléculas de ácido ascórbico de
Dados
MC6H8O6= 176 g mol-1
N° Avogadro = 6 x 1023 moléculas . mol-1
Um comprimido efervescente de vitamina C contém 500 mg de ácido ascórbico (C6H8O6 ). Quando um paciente bebe água em que foram dissolvidos dois comprimidos de vitamina C, ele consumiu um número mais próximo de moléculas de ácido ascórbico de
Dados
MC6H8O6= 176 g mol-1
N° Avogadro = 6 x 1023 moléculas . mol-1
A redução de grandes quantidades de dióxido de silício é
um processo industrial importante descrito pela equação
química abaixo.
SiO2(s) + C(s) → Si(s) + CO2(g)
Considerando a reação completa, a massa de silício, em
gramas, formada pela reação de 24.000 g de SiO2
com
excesso de carbono é
Dados
M(Si): 28 g mol-1
M(O): 16 g mol-1
Na metalurgia, o cromo metálico pode ser obtido pela reação de seu óxido com alumínio, de acordo com a equação
abaixo.
2 Al(s) + Cr2O3(s) → Al2O3(s) + 2 Cr(s)
Considerando as massas iniciais de 108 g de Al, 400 g
de Cr2O3
e o rendimento da reação de 80%, a massa, em
gramas de Cr, obtida é
Dados
MAl
= 27 g mol-1
MCr2O3
= 152 g mol L-1
MCr = 52 g mol-1
Na metalurgia, o cromo metálico pode ser obtido pela reação de seu óxido com alumínio, de acordo com a equação abaixo.
2 Al(s) + Cr2O3(s) → Al2O3(s) + 2 Cr(s)
Considerando as massas iniciais de 108 g de Al, 400 g de Cr2O3 e o rendimento da reação de 80%, a massa, em gramas de Cr, obtida é
Dados
MAl = 27 g mol-1
MCr2O3 = 152 g mol L-1
MCr = 52 g mol-1
As nanopartículas de prata, usadas em diversas aplicações tecnológicas, podem ser preparadas, em solução
aquosa, pela redução de íons Ag+ usando boro-hidreto de sódio (NaBH4), como indicado na equação abaixo:
AgNO3 (aq) + NaBH4(aq) → Ag (s) + ½ H2(g) + ½ B2H6(g) + NaNO3(aq)
A partir de 100,00 mL de uma solução 2,0 × 10-3 mol L-1 de AgNO3, qual seria a massa mínima de NaBH4
necessária para a reação completa de Ag+ para Ag, expressa em gramas?
Dados:
M(AgNO3) = 170 g mol-1
M(Ag) = 108 g mol-1
M(NaBH4) = 38 g mol-1
As nanopartículas de prata, usadas em diversas aplicações tecnológicas, podem ser preparadas, em solução aquosa, pela redução de íons Ag+ usando boro-hidreto de sódio (NaBH4), como indicado na equação abaixo:
AgNO3 (aq) + NaBH4(aq) → Ag (s) + ½ H2(g) + ½ B2H6(g) + NaNO3(aq)
Dados:
M(AgNO3) = 170 g mol-1
M(Ag) = 108 g mol-1
M(NaBH4) = 38 g mol-1
O nióbio é um metal usado para produção de ligas especiais. Ele é obtido a partir da redução do pentóxido de
nióbio na presença de alumínio e óxido de ferro (III), como mostrado na equação química a seguir:
3 Nb2O5 (s) + Fe2O3 (s) + 12 Al (s) → 6 Nb (s) + 2 Fe (s) + 6 Al2O3 (s)
Assumindo o rendimento completo da reação, a massa mais próxima de nióbio metálico, em kg, que seria obtida a
partir de 850 kg de Nb2O5 é:
Dados:M (Nb) = 93 g mol-1M (Nb2O5) = 266 g mol-1
Um volume de 100 mL de uma solução aquosa de NaC 0,100 mol L-1
foi misturado com 50 mL de solução de Pb(NO3)2
0,050 mol L-1. A alternativa que indica mais proximamente a massa, em g, de PbCℓ2(s) produzida, assumindo reação com
100% de rendimento é a
Dado
M PbCℓ2
= 278 g mol-1
Um volume de 100 mL de uma solução aquosa de NaC 0,100 mol L-1 foi misturado com 50 mL de solução de Pb(NO3)2 0,050 mol L-1. A alternativa que indica mais proximamente a massa, em g, de PbCℓ2(s) produzida, assumindo reação com 100% de rendimento é a
Dado
M PbCℓ2
= 278 g mol-1
A água é a molécula da vida, pois os seres vivos são constituídos
em grande parte por esta substância, sendo ela
responsável pelo bom funcionamento dos organismos.
Sobre a molécula de água é correto que
Uma amostra de um composto orgânico foi queimada em
atmosfera rica em oxigênio de forma a transformar todo
o carbono em gás CO2
. Esse gás foi borbulhado em uma
solução de hidróxido de bário, onde todo o CO2
foi precipitado
na forma de BaCO3
(ver equação). Se 0,106 g
de amostra produziu 0,296 g de BaCO3
, a percentagem
(valor mais próximo) de carbono na substância é 

Explosões são reações químicas que liberam muita energia.
A energia liberada em explosões tem como parâmetro
de medição o equivalente em tinitrotolueno (TNT) que, ao
explodir, produz 4,2 x 102J por cada 1 g.
A bomba atômica que foi lançada sobre Hiroshima (em
1945) produziu uma explosão com energia de 6,3 x 1013J.
A quantidade, em mol, de TNT, que produziria uma energia
dessa magnitude, assumindo uma reação com 100%
de rendimento, seria: 

Uma amostra de um composto orgânico foi queimada em
atmosfera rica em oxigênio de forma a transformar todo
o carbono em gás CO2
. Esse gás foi borbulhado em uma
solução de hidróxido de bário, onde todo o CO2
foi precipitado
na forma de BaCO3
(ver equação). Se 0,106 g
de amostra produziu 0,296 g de BaCO3
, a percentagem
(valor mais próximo) de carbono na substância éCO2(g) + Ba2+
(aq) → BaCO3(s)
Dados MCO2 = 44 g mol-1
e MBaCO3 197g mol-1
Explosões são reações químicas que liberam muita energia.
A energia liberada em explosões tem como parâmetro
de medição o equivalente em tinitrotolueno (TNT) que, ao
explodir, produz 4,2 x 102
J por cada 1 g.
A bomba atômica que foi lançada sobre Hiroshima (em
1945) produziu uma explosão com energia de 6,3 x 1013 J.
A quantidade, em mol, de TNT, que produziria uma energia
dessa magnitude, assumindo uma reação com 100%
de rendimento, seria:Dados
TNT: C7
H5
(NO2
)
3
MTNT = 227 g mol-1
Uma amostra de um composto orgânico foi queimada em
atmosfera rica em oxigênio de forma a transformar todo
o carbono em gás CO2
. Esse gás foi borbulhado em uma
solução de hidróxido de bário, onde todo o CO2
foi precipitado
na forma de BaCO3
(ver equação). Se 0,106 g
de amostra produziu 0,296 g de BaCO3
, a percentagem
(valor mais próximo) de carbono na substância é
CO2(g) + Ba2+(aq) → BaCO3(s)
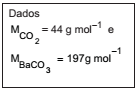
Uma amostra de um composto orgânico foi queimada em atmosfera rica em oxigênio de forma a transformar todo o carbono em gás CO2 . Esse gás foi borbulhado em uma solução de hidróxido de bário, onde todo o CO2 foi precipitado na forma de BaCO3 (ver equação). Se 0,106 g de amostra produziu 0,296 g de BaCO3 , a percentagem (valor mais próximo) de carbono na substância é
CO2(g) + Ba2+(aq) → BaCO3(s)

Explosões são reações químicas que liberam muita energia.
A energia liberada em explosões tem como parâmetro
de medição o equivalente em tinitrotolueno (TNT) que, ao
explodir, produz 4,2 x 102J por cada 1 g.
A bomba atômica que foi lançada sobre Hiroshima (em
1945) produziu uma explosão com energia de 6,3 x 1013 J.
A quantidade, em mol, de TNT, que produziria uma energia
dessa magnitude, assumindo uma reação com 100%
de rendimento, seria:

Explosões são reações químicas que liberam muita energia. A energia liberada em explosões tem como parâmetro de medição o equivalente em tinitrotolueno (TNT) que, ao explodir, produz 4,2 x 102J por cada 1 g.
A bomba atômica que foi lançada sobre Hiroshima (em 1945) produziu uma explosão com energia de 6,3 x 1013 J. A quantidade, em mol, de TNT, que produziria uma energia dessa magnitude, assumindo uma reação com 100% de rendimento, seria:
