Questõesde FATEC sobre Representação das transformações químicas
A reação química da produção da fosfina pode ser representada pela equação
AlP (s) + 3 H2O (l) → Al (OH)3 (s) + PH3 (g)
Considerando que toda a massa de fosfeto de alumínio reagiu com a água e que o rendimento da reação é 100%,
o volume aproximado de fosfina produzido no local, em litros, é
Dados:
Volume molar dos gases nas
condições descritas: 30 L/mol
Massas molares em g/mol:
Al = 27, P = 31
De acordo com o texto, quando o primeiro grupo chegar a Marte, o sistema de suporte à vida da missão já terá estocado uma quantidade de oxigênio, O2, correspondente a
Dados:Massa Molar: O = 16 g/mol
Para cada molde xenônio que reage completamente,
a massa do produto formado na reação é, em
gramas,
Massas molares em g/mol:
Xe = 131; Pt = 195; F = 19
Os isótopos representados contidos nos cartões de Paulo
e Gabriela podem reagir entre si para formar óxido de lítio,
segundo a reação balanceada
4 Li (s) + O2 (g) → 2 Li2O (s)
A massa de lítio necessária para reagir completamente
com 3,2 kg de oxigênio é, em quilogramas,
Massas molares:
Li: 7 g/mol
O: 16 g/mol

Considere uma vela composta de um hidrocarboneto
( fórmula molecular C22H46 ) cuja combustão completa
libera apenas gás carbônico e água.
Pode-se concluir corretamente que, na combustão
completa de 1 mol desse hidrocarboneto, as quantidades
de matéria, e CO2 e de H2O produzidas são, em mol,
respectivamente, iguais a
A reação química que ocorre entre as substâncias denominadas por Lavoisier como carbonato de soda e ácido muriático
é evidenciada pela formação rápida de um gás que é muito conhecido por ser um dos responsáveis pela intensificação do
efeito estufa e por ser indispensável à realização da fotossíntese vegetal.
Esse gás é o que, antigamente, era chamado de
Leia o texto para responder a questão.
Em seu livro Tratado Elementar de Química, publicado em 1789, Antonie Lavoisier estabeleceu uma nova nomenclatura para diversas substâncias químicas. Alguns exemplos, extraídos desse livro, são dados no quadro.
Nome antigo Nome proposto por Lavoisier Nome atual
ar vital oxigênio oxigênio
ar inflamável hidrogênio hidrogênio
ar fixo ácido carbônico dióxido de carbono
ácido vitriólico ácido sulfúrico ácido sulfúrico
vitríolo azul; vitríolo de cobre sulfato de cobre sulfato de cobre (II)
ácido marinho ácido muriático ácido clorídrico
sal marinho muriato de soda cloreto de sódio
soda aerada; soda efervescente carbonato de soda carbonato de sódio
Hidrocarbonetos podem ser usados como combustível,
por exemplo o gás but-1-eno.
Assinale a alternativa que apresenta a fórmula molecular
e a quantidade mínima, em kg, de gás oxigênio necessária
para a combustão completa de 5,6 kg desse combustível.
Massas Molares:
H = 1 g/mol
O = 16 g/mol
C = 12 g/mo
FÓRMULA C3H6
MASSA (Kg) 19,2
FÓRMULA C4H8
MASSA (Kg) 3,2
FÓRMULA C3H6
MASSA (Kg) 3,2
FÓRMULA C4H10
MASSA (Kg) 19,2
Considerando que uma colher de chá de bicarbonato de sódio contém 5 g desse composto, é correto afirmar que o número
de moléculas de bicarbonato de sódio utilizadas na fabricação do slime caseiro, conforme descrito no texto, corresponde a
aproximadamente
Massa molar do NaHCO3 = 84 g/mol
Constante de Avogadro: 6 × 1023 mol–1




Determinado veículo foi submetido à inspeção veicular ambiental obrigatória, para obter o licenciamento no município de São Paulo.
Nessa inspeção, após aprovado em uma verificação prévia que leva em conta vazamentos, estado do escapamento e condições de
ruído, o veículo passa por medições de marcha lenta e de emissão e diluição de gases, que devem estar dentro de certos limites. Os
limites para a emissão e diluição de gases valem também para o motor funcionando em alta rotação.
As tabelas I, II e III mostram os valores limites para o veículo em questão e os valores medidos.

Analisando-se esses dados, conclui-se que o veículo submetido à inspeção deve ter sido
As tabelas I, II e III mostram os valores limites para o veículo em questão e os valores medidos.

Analisando-se esses dados, conclui-se que o veículo submetido à inspeção deve ter sido
O monitoramento da qualidade do ar em São Paulo é realizado, diariamente, pela CETESB (Companhia Ambiental do Estado de São Paulo), a
fim de determinar o nível de concentração de um grupo de poluentes universalmente consagrados como indicadores.
Esses indicadores foram selecionados devido à sua maior frequência na atmosfera e também devido aos efeitos adversos que causam ao meio
ambiente. Para cada um deles, foram definidos padrões de qualidade do ar, ou seja, limites máximos de concentração que, quando ultrapassados,
podem afetar a saúde, a segurança e o bem-estar da população, bem como ocasionar danos ao meio ambiente em geral.
Assim, por exemplo, o estudo de um desses indicadores demonstrou que não se devem deixar veículos com o motor em funcionamento em
ambientes pouco ventilados, como garagens fechadas e túneis sem circulação adequada de ar, porque ele se combina com moléculas de
hemoglobina, inutilizando-as irreversivelmente para o transporte de oxigênio.
Esse indicador é um gás inodoro representado pela fórmula molecular
Esses indicadores foram selecionados devido à sua maior frequência na atmosfera e também devido aos efeitos adversos que causam ao meio ambiente. Para cada um deles, foram definidos padrões de qualidade do ar, ou seja, limites máximos de concentração que, quando ultrapassados, podem afetar a saúde, a segurança e o bem-estar da população, bem como ocasionar danos ao meio ambiente em geral.
Assim, por exemplo, o estudo de um desses indicadores demonstrou que não se devem deixar veículos com o motor em funcionamento em ambientes pouco ventilados, como garagens fechadas e túneis sem circulação adequada de ar, porque ele se combina com moléculas de hemoglobina, inutilizando-as irreversivelmente para o transporte de oxigênio.
Esse indicador é um gás inodoro representado pela fórmula molecular
Um veículo de passeio, movido a gasolina, deixou a capital paulista com o tanque cheio, dirigindo-se a uma
cidade do interior situada a 480 km, na região noroeste do estado. Ao final da viagem, verificou-se que o
consumo médio do veículo foi de 16 km por litro de combustível.
Admitindo-se que a composição média da gasolina seja dada pela fórmula C8
H18 e que a combustão seja
completa, conclui-se que o volume de CO2
, em litros, medido nas CATP e lançado ao ar durante a viagem foi
de, aproximadamente,
Dados
Volume molar de gás nas CATP = 25 L / mol
Densidade da gasolina = 8 x 102 g / L
Massas molares em g / mol:
C = 12; H = 1 e O = 16
Um veículo de passeio, movido a gasolina, deixou a capital paulista com o tanque cheio, dirigindo-se a uma cidade do interior situada a 480 km, na região noroeste do estado. Ao final da viagem, verificou-se que o consumo médio do veículo foi de 16 km por litro de combustível.
Admitindo-se que a composição média da gasolina seja dada pela fórmula C8 H18 e que a combustão seja completa, conclui-se que o volume de CO2 , em litros, medido nas CATP e lançado ao ar durante a viagem foi de, aproximadamente,
Dados
Volume molar de gás nas CATP = 25 L / mol
Densidade da gasolina = 8 x 102 g / L
Massas molares em g / mol:
C = 12; H = 1 e O = 16
Quando comprimidos ou pós-efervescentes são adicionados à água, ocorre reação química, com liberação de gás carbônico. Sendo assim, considere o seguinte experimento:

Com base nesses dados, calcula-se que a massa, em gramas, de gás carbônico liberado para o ar pela reação foi igual a

Com base nesses dados, calcula-se que a massa, em gramas, de gás carbônico liberado para o ar pela reação foi igual a
Considere a reação química entre soluções aquosas de carbonato de sódio (Na2 CO3 ) e cloreto de cálcio (CaCl 2 ), produzindo carbonato de cálcio sólido (CaCO3 ) e cloreto de sódio (NaCl) em solução aquosa.
Supondo rendimento de 100%, a massa, em gramas, de cloreto de cálcio que deve reagir para produzir 10 g de carbonato de cálcio é, aproximadamente,
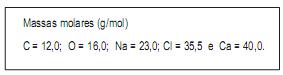
Supondo rendimento de 100%, a massa, em gramas, de cloreto de cálcio que deve reagir para produzir 10 g de carbonato de cálcio é, aproximadamente,
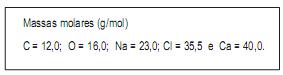
Um jovem empreendedor, recém-formado em um curso de Química, resolveu iniciar um negócio de reciclagem envolvendo a obtenção de prata a partir de chapas de raios X descartadas e de soluções de fixador fotográfico após seu uso.
Consultando artigos em revistas especializadas, verificou que, empregando métodos, materiais e reagentes simples, poderia obter, em média, 5 gramas de prata por metro quadrado de chapas de raios X e 5 gramas de prata por litro da solução de fixador.
Para testar essas informações, o jovem decidiu utilizar 10 chapas retangulares de 30 cm x 40 cm e 2 L de solução de fixador.
Caso as informações consultadas estejam corretas, ele deverá obter uma massa total de prata, em gramas, próxima de
Consultando artigos em revistas especializadas, verificou que, empregando métodos, materiais e reagentes simples, poderia obter, em média, 5 gramas de prata por metro quadrado de chapas de raios X e 5 gramas de prata por litro da solução de fixador.
Para testar essas informações, o jovem decidiu utilizar 10 chapas retangulares de 30 cm x 40 cm e 2 L de solução de fixador.
Caso as informações consultadas estejam corretas, ele deverá obter uma massa total de prata, em gramas, próxima de