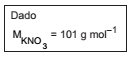Na equação, está representada uma reação de polimerização,
na qual um hidrocarboneto do tipo olefina produz
um polímero identificado pela sigla PMP. O PMP possui
elevada resistência (química e térmica) e alto grau de
transparência. Devido a essas características, ele tem
sido utilizado como matéria-prima para obtenção de utensílios
de laboratório.

Sobre essa olefina e o PMP, verifica-se que
Na equação, está representada uma reação de polimerização, na qual um hidrocarboneto do tipo olefina produz um polímero identificado pela sigla PMP. O PMP possui elevada resistência (química e térmica) e alto grau de transparência. Devido a essas características, ele tem sido utilizado como matéria-prima para obtenção de utensílios de laboratório.

Sobre essa olefina e o PMP, verifica-se que