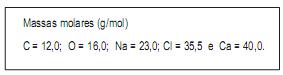3a6dfb84-b2
FATEC 2018 - Química - Grandezas: massa, volume, mol, massa molar, constante de Avogadro e Estequiometria., Representação das transformações químicas
A reação química da produção da fosfina pode ser representada pela equação
AlP (s) + 3 H2O (l) → Al (OH)3 (s) + PH3 (g)
Considerando que toda a massa de fosfeto de alumínio reagiu com a água e que o rendimento da reação é 100%,
o volume aproximado de fosfina produzido no local, em litros, é
Dados:
Volume molar dos gases nas
condições descritas: 30 L/mol
Massas molares em g/mol:
Al = 27, P = 31
A reação química da produção da fosfina pode ser representada pela equação
AlP (s) + 3 H2O (l) → Al (OH)3 (s) + PH3 (g)
Considerando que toda a massa de fosfeto de alumínio reagiu com a água e que o rendimento da reação é 100%,
o volume aproximado de fosfina produzido no local, em litros, é
Dados:
Volume molar dos gases nas
condições descritas: 30 L/mol
Massas molares em g/mol:
Al = 27, P = 31
Leia o texto para responder à questão.
Um incêndio atingiu uma fábrica de resíduos industriais em Itapevi, na Grande São Paulo. O local armazenava três
toneladas de fosfeto de alumínio (A P). De acordo com a Companhia Ambiental do Estado de São Paulo (Cetesb), o fosfeto
de alumínio reagiu com a água usada para apagar as chamas, produzindo hidróxido de alumínio e fosfina (PH3).
A fosfina é um gás tóxico, incolor, e não reage com a água, porém reage rapidamente com o oxigênio liberando
calor e produzindo pentóxido de difosfóro (P2O5). Segundo os médicos, a inalação do P2O5 pode causar queimadura tanto
na pele quanto nas vias respiratórias devido à formação de ácido fosfórico.
A
3,33 × 102
.
B
3,33 × 103
.
C
3,33 × 106
.
D
1,55 × 103
.
E
1,55 × 106.