À temperatura ambiente, o metanol evapora com mais facilidade que o etanol. Com base
nessa informação, é CORRETO concluir que o metanol, quando comparado ao etanol,
apresenta:


O trióxido de enxofre (SO3) é obtido a partir da reação do dióxido de enxofre (SO2) com o gás oxigênio (O2), representada pelo equilíbrio a seguir.
2 SO2(g) + O2(g) 2 SO3(g) ΔHθ = - 198 kJ
A constante de equilíbrio, KC, para esse processo a 1000o C é igual a 280. A respeito dessa reação, foram feitas as seguintes afirmações:
I. A constante de equilíbrio da síntese do SO3 a 200o C deve ser menor que 280.
II. Se na condição de equilíbrio a 1000o C a concentração de O2 é de 0,1 mol.L-1 e a concentração de SO2 é de 0,01 mol.L-1, então a concentração de SO3 é de 2,8 mol.L-1.
III. Se, atingida a condição de equilíbrio, o volume do recipiente for reduzido sem alteração na temperatura, não haverá alteração no valor da constante de equilíbrio, mas haverá aumento no rendimento de formação do SO3.
IV. Essa é uma reação de oxirredução, em que o dióxido de enxofre é o agente redutor.
• Estão corretas apenas as afirmações:

A pirita (FeS2 ) é encontrada na natureza agregada a pequenas quantidades de níquel, cobalto, ouro e cobre. Os cristais de pirita são semelhantes ao ouro e, por isso, são chamados de ouro dos tolos. Esse minério é utilizado industrialmente para a produção de ácido sulfúrico. Essa produção ocorre em várias etapas, sendo que a primeira é a formação do dióxido de enxofre, segundo a equação a seguir.
4 FeS2(s)+ 11 O2(g) → 2 Fe2 O3(s) + 8 SO2(g)
Na segunda etapa, o dióxido de enxofre reage com oxigênio para formar trióxido de enxofre e, por fim, o trióxido de enxofre reage com água, dando origem ao ácido sulfúrico.
Sabendo que o minério de pirita apresenta
92% de pureza, calcule a massa aproximada de
dióxido de enxofre produzida a partir de 200 g
de pirita.
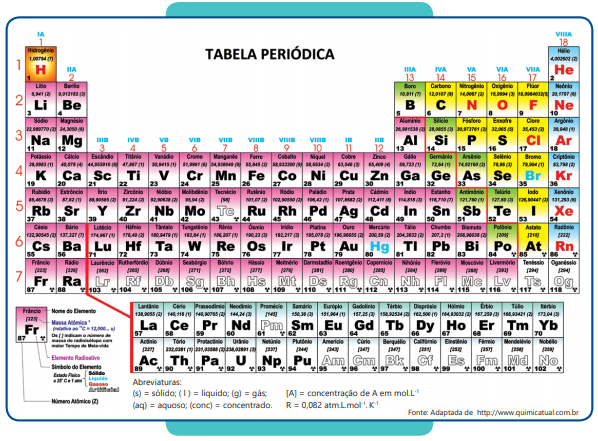



Na metalurgia, o cromo metálico pode ser obtido pela reação de seu óxido com alumínio, de acordo com a equação abaixo.
2 Al(s) + Cr2O3(s) → Al2O3(s) + 2 Cr(s)
Considerando as massas iniciais de 108 g de Al, 400 g de Cr2O3 e o rendimento da reação de 80%, a massa, em gramas de Cr, obtida é
Dados
MAl = 27 g mol-1
MCr2O3 = 152 g mol L-1
MCr = 52 g mol-1
As nanopartículas de prata, usadas em diversas aplicações tecnológicas, podem ser preparadas, em solução aquosa, pela redução de íons Ag+ usando boro-hidreto de sódio (NaBH4), como indicado na equação abaixo:
AgNO3 (aq) + NaBH4(aq) → Ag (s) + ½ H2(g) + ½ B2H6(g) + NaNO3(aq)
Dados:
M(AgNO3) = 170 g mol-1
M(Ag) = 108 g mol-1
M(NaBH4) = 38 g mol-1