O cloreto de cobalto(II) anidro, CoCℓ2
, é um sal de cor azul,
que pode ser utilizado como indicador de umidade, pois
torna-se rosa em presença de água. Obtém-se esse sal
pelo aquecimento do cloreto de cobalto(II) hexa-hidratado,
CoCℓ2
.6H2O, de cor rosa, com liberação de vapor de água.
sal hexa-hidratado (rosa) 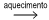 sal anidro (azul) + vapor de água
sal anidro (azul) + vapor de água
A massa de sal anidro obtida pela desidratação completa de
0,1 mol de sal hidratado é, aproximadamente,
O cloreto de cobalto(II) anidro, CoCℓ2 , é um sal de cor azul, que pode ser utilizado como indicador de umidade, pois torna-se rosa em presença de água. Obtém-se esse sal pelo aquecimento do cloreto de cobalto(II) hexa-hidratado, CoCℓ2 .6H2O, de cor rosa, com liberação de vapor de água.
sal hexa-hidratado (rosa) 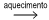 sal anidro (azul) + vapor de água
sal anidro (azul) + vapor de água
A massa de sal anidro obtida pela desidratação completa de 0,1 mol de sal hidratado é, aproximadamente,


