O nitrato de cobre pode ser obtido pela reação entre o cobre metálico com o ácido nítrico, conforme a equação
química não-balanceada a seguir.

Quando balanceada, a soma dos menores coeficientes inteiros estequiométricos é igual a


Em uma indústria do Estado de São Paulo que produz ácido sulfúrico 98% a partir da queima de enxofre elementar, com capacidade de produção inicial de 600 toneladas por dia, ocorreu uma emissão de gás dióxido de enxofre (SO2). Essa emissão de gás ultrapassou as fronteiras da fábrica de ácido sulfúrico e atingiu a população do entorno. Várias pessoas apresentaram agravos à saúde relacionados ao caso, como irritação das vias aéreas, desmaios, vômitos e enjoos, demandando atendimento hospitalar de emergência em hospitais da região. Também foram acionados o Serviço de Atendimento Médico de Urgência (SAMU) e o Corpo de Bombeiros.
JÚNIOR, L.M.; LORENZI, R.L. Revista brasileira de saúde ocupacional. São Paulo: 32(116): 31-37, 2007. (Adaptado)
Sobre o assunto, é CORRETO afirmar que:
para a produção de 600 toneladas de ácido sulfúrico são necessárias cerca de 400 toneladas
de S.
Quando se balancear uma reação química, deve-se obedecer à lei da conservação da massa. Ao se balancear reações de oxirredução, existe uma exigência adicional: os elétrons recebidos e doados devem estar balanceados.
Desta forma, é correto afirmar que a reação de oxirredução entre o íon permanganato e o íon oxalato em solução aquosa ácida, representada abaixo, estará balanceada quando os coeficientes estequiométricos forem, respectivamente:
 Mn2+ (aq) + H2O (l) + CO2 (g)
Mn2+ (aq) + H2O (l) + CO2 (g)

1 - 3 - 8 - 1 - 4 - 5

C11H26NO2PS
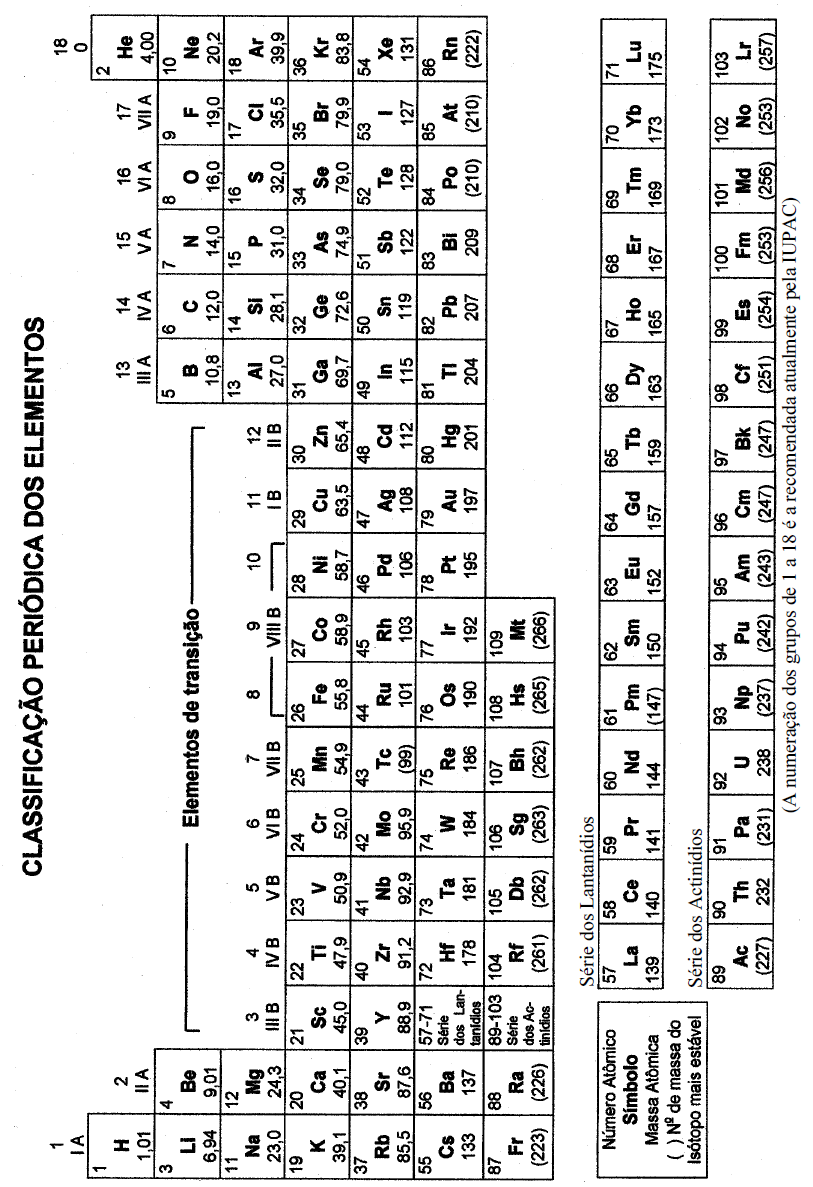
O metal alcalino terroso (M) pertencente ao terceiro período da tabela periódica forma um cátion estável presente na natureza em diversos minerais. O ânion monovalente do elemento não metálico (X) é isoeletrônico (tem a mesma quantidade de elétrons) desse cátion e forma com ele o composto iônico com fórmula unitária MX2 .
Assinale a alternativa que apresenta o número atômico do elemento representado por X.
DADOS QUE PODEM SER USADOS NESTA PROVA:

A produção da alumina a partir da bauxita, minério de alumínio, envolve uma série de etapas. Entre elas está a calcinação, na qual ocorre a seguinte reação:
Al(OH)3 ----> Al2 O3 + H2O
O balanceamento correto dessa reação, com os menores números inteiros, é dado, respectivamente, por:
A queima de uma substância se dá pela reação de combustão entre um comburente e um combustível. Diversos produtos podem ser formados nesta reação, como H2O, CO2, CO, H2 e CH4. Alguns destes componentes podem causar a chuva ácida que prejudica o meio ambiente com danos aos ciclos biogeoquímicos do planeta e o agravamento do efeito estufa. A combustão completa de uma substância produz gás carbônico e água como produtos. Considere a reação de combustão completa do etileno mostrada abaixo.
C2H4 + 3O2 → 2CO2 + 2H2O
Considere as massas molares de C2H4, O2 e CO2 iguais a 28 g/mol, 32 g/mol e 44 g/mol, respectivamente e assinale a alternativa correta que apresenta quantos gramas de CO2 serão formados com uma massa inicial de C2H4 igual a 2g e de O2 igual a 6g e se a reação é endotérmica ou exotérmica.
x y
15 85
x y
45 170
x y
9 34
x y
6 34
x y
2 17


Boyle-Mariotte.