d55b1982-d9
UEM 2010, UEM 2010, UEM 2010 - Química - Fórmulas, Balanceamento e Leis ponderais das reações químicas, Representação das transformações químicas
17,0 g de amônia, não restando nenhum dos
gases reagentes.
17,0 g de amônia, não restando nenhum dos
gases reagentes.
CLASSIFICAÇÃO PERIÓDICA DOS ELEMENTOS
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO
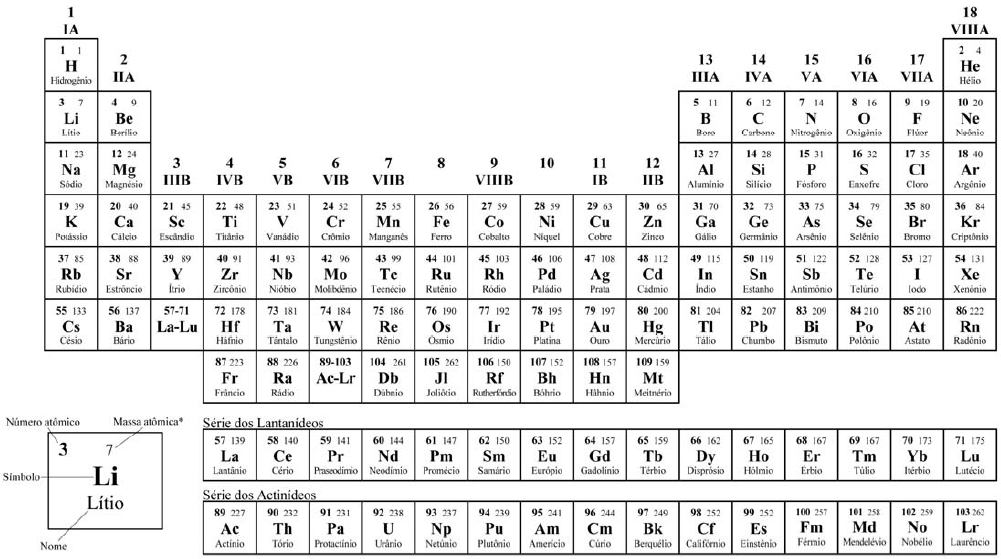
*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
Misturando-se 3,0 g de hidrogênio (H2) e 20,0 g de nitrogênio (N2) em um balão de vidro, provocando a reação entre os gases, de acordo com a equação abaixo
3 H2(g) + 1 N2(g) → 2 NH3(g)
e admitindo-se 100% de rendimento dessa reação,
é correto afirmar que obteremos
C
Certo
E
Errado






