Na tabela, são apresentadas informações dos rótulos de dois
produtos comercializados por uma indústria alimentícia.
Água de coco
Ingredientes Água de coco, água
de coco concentrada
reconstituída, sacarose
(menos de 1% para
padronização do produto)
e conservador INS223
Óleo de coco IngredientesÓleo vegetal de
coco-da-bahia (Cocos
nucifera L.) extraído
em primeira prensagem
mecânica.
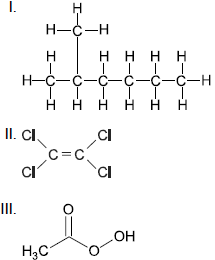
Para melhorar as qualidades nutricionais desses produtos,
o fabricante pretende adicionar a cada um deles vitaminas
solúveis, tendo como opção aquelas representadas na figura.

Considerando as vitaminas apresentadas, são mais solúveis
na água de coco as __ (I)__ , e mais solúveis no óleo
de coco as __(II)__ .
Assinale a alternativa que preenche corretamente as lacunas.
Para melhorar as qualidades nutricionais desses produtos, o fabricante pretende adicionar a cada um deles vitaminas solúveis, tendo como opção aquelas representadas na figura.

Considerando as vitaminas apresentadas, são mais solúveis na água de coco as __ (I)__ , e mais solúveis no óleo de coco as __(II)__ .
Assinale a alternativa que preenche corretamente as lacunas.