Questõessobre Estrutura Atômica: números de massa, átomo neutro e íon, elemento químico e semelhanças atômicas
Analise a tabela, que mostra a composição de alguns minerais de ferro.
Mineral Composição Massa molar (g/mol)
goethita Fe2O3 . H2O 178hematita Fe2O3 160
pirita FeS2 120
siderita FeCO3 116
Os minerais que apresentam maior e menor porcentagem em
massa de ferro são, respectivamente,
Mineral Composição Massa molar (g/mol)
goethita Fe2O3 . H2O 178
pirita FeS2 120
siderita FeCO3 116
Os minerais que apresentam maior e menor porcentagem em massa de ferro são, respectivamente,
O íon  e o átomo
e o átomo 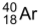 apresentam o mesmo número
apresentam o mesmo número
O íon  e o átomo
e o átomo 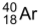 apresentam o mesmo número
apresentam o mesmo número
Existem elementos químicos considerados essenciais,
em cuja ausência não seria possível haver vida. Esses
elementos estão envolvidos em importantes processos
biológicos, como nos processos osmóticos, na
construção de biomoléculas e nas funções estruturais
dos organismos. Dentre eles, estão o flúor (F), sódio
(Na) e Magnésio (Mg). Nos sistemas biológicos, estes
elementos se apresentam em sua forma iônica, como
F
-
, Na+ e Mg2+. Em ordem crescente, como se
classifica o raio iônico dos íons F-
, Na+ e Mg2+?
Dados: Números atômicos: F = 9; Na = 11; Mg = 12.
O metal alcalino terroso (M) pertencente ao terceiro período
da tabela periódica forma um cátion estável presente na natureza em diversos minerais. O ânion monovalente do elemento não metálico (X) é isoeletrônico (tem a mesma quantidade
de elétrons) desse cátion e forma com ele o composto iônico
com fórmula unitária MX2
.
Assinale a alternativa que apresenta o número atômico do
elemento representado por X.

Elementos químicos conhecidos como terras
raras – a exemplo do cério, promécio, gadolínio,
érbio e lutécio, da série dos lantanídeos, citados na
tabela, e do escândio e ítrio, elementos de números
atômicos, respectivamente, 21 e 39 – são utilizados
em um número cada vez maior de equipamentos,
como lâmpadas, telas de televisores, computadores
e celulares, turbinas eólicas, entre outros. Apesar
do nome terras raras – porque, no início, eram
conhecidos apenas na Escandinávia, e a extração
dos óxidos era difícil –, hoje se sabe que os
lantanídeos mais raros, como o túlio e o lutécio, são
mais abundantes do que a prata, o ouro e a platina.
SILVEIRA, Evanildo da. O ouro do século XXI. Planeta. São Paulo: Três, a. 45,
e. 533, ago. 2017, p. 36-39. Adaptado.
Considerando-se as informações e as propriedades dos
elementos químicos, é correto afirmar:

 , é isótono do átomo de túlio, Tm,
que possui 69 prótons e 100 nêutrons no núcleo.
, é isótono do átomo de túlio, Tm,
que possui 69 prótons e 100 nêutrons no núcleo.O que tem futebol a ver com química? Tudo, se o assunto
for a bola. Com 12 pentágonos e 20 hexágonos, ela tem a
mesma estrutura de uma forma elementar do carbono, chamada de fulereno, cuja descoberta valeu o Nobel de Química
de 1996. Na natureza, a molécula é encontrada no espaço
interestelar e, em pequenas concentrações, na fumaça do
cigarro. Em laboratório, pode ser obtida pela irradiação de
uma superfície de grafite com laser. Um fulereno, representado quimicamente como C60 , tem 60 átomos de carbono,
assim como a bola tem 60 vértices.
(www.jornaldaciencia.org.br. Adaptado.)

No texto são citados dois_________________ do elemento carbono. No C60, cada átomo de carbono faz____________________ligações sigma.
As lacunas do texto são preenchidas, correta e respectivamente, por

O processo de reação nuclear mais importante na
natureza é o que ocorre nas estrelas, conhecido como
nucleossíntese estrelar. A fusão de núcleos atômicos
em uma estrela, a partir da abundância de hidrogênio
e hélio iniciais, fornece energia e sintetiza novos
núcleos como subprodutos do processo de fusão. A
reação produtora de energia é a fusão de hidrogênio,
deutério e trítio para formar hélio, que ocorre no núcleo
do Sol à temperatura de 14 milhões de kelvin.
Com relação a essa descrição, três afirmações foram
feitas:
1)  são isótopos do hidrogênio.2)
são isótopos do hidrogênio.2)  são elementos isóbaros.3)
são elementos isóbaros.3)  são elementos isótonos.
são elementos isótonos.
Está(ão) correta(s) a(s) afirmativa(s):
 são isótopos do hidrogênio.
são isótopos do hidrogênio. são elementos isóbaros.
são elementos isóbaros. são elementos isótonos.
são elementos isótonos.Está(ão) correta(s) a(s) afirmativa(s):
Na década de 1970, através da ajuda da UNICEF,
foram perfurados cerca de 10 milhões de poços
artesianos para levar água à população de
Bangladesh. Esse caso é conhecido como o maior
envenenamento da história, pois não era do
conhecimento dos governantes a presença de um
elemento químico extremamente tóxico nos lençóis
freáticos, o arsênio. Dezenas de milhões de pessoas
foram contaminadas pelo arsênio, que, em sua forma
de íon As3+, possui 30 elétrons e 42 nêutrons. Qual é o
número atômico e o número de massa do arsênio em
sua forma neutra, respectivamente?
O brometo de potássio (KBr) é um importante sal
anticonvulsivante, utilizado tanto em humanos como
em cães. Quando comparados os elementos que o
constituem, bromo (Br) e potássio (K), podemos dizer
acerca das suas propriedades periódicas:
O número de massa de um dos isótopos do potássio é
40. Este isótopo sofre um lento decaimento radioativo
por captura de elétrons, e forma o isótopo de massa
40 do argônio (número atômico 18). Outro decaimento
que também ocorre com o isótopo do potássio 40 é
emissão de partículas beta. Considerando as
afirmações acima, podemos afirmar o que segue.
A regra de Hund, como o próprio nome indica,
foi formulada pela primeira vez, em 1927, pelo físico
alemão Friedrich Hund. Ele partiu diretamente da
estrutura nuclear, já conhecida e medida, das
moléculas e tentou calcular as orbitais moleculares
adequadas por via direta, resultando na regra de
Hund. Essa regra afirma que a energia de um orbital
incompleto é menor quando nela existe o maior
número possível de elétrons com spins paralelos.
Considerando a distribuição eletrônica do átomo de
enxofre em seu estado fundamental (Z = 16),
assinale a opção que apresenta a aplicação correta
da regra de Hund.
ELEMENTO NÚMERO MASSA
QUÍMICO ATÔMICO ATÔMICA
H 1 1,0
C 6 12,0
N 7 14,0
O 8 16,0
F 9 19,0
Na 11 23,0
Si 14 28,1
P 15 31,0
S 16 32,0
Cl 17 35,5
K 19 39,0
Cr 24 52,0
Cu 29 63,5
As 33 75,0
Br 35 80,0
Ag 47 108,0
Sn 50 119,0
Ir 77 192,0
Au 79 197,0
Hg 80 200,0
1s2 2s2 2p6 3s2 3px2 3py1 3pz1
Analise os pares de elementos químicos a seguir.
(20Ca40 e 19K
40) – (17Cℓ
35 e 17Cℓ
37) – (5B
11 e 6Cℓ
12)
Assinale a alternativa que apresenta, correta e respectivamente, as características desses pares de elementos químicos.
Analise os pares de elementos químicos a seguir.
(20Ca40 e 19K 40) – (17Cℓ 35 e 17Cℓ 37) – (5B 11 e 6Cℓ 12)
Assinale a alternativa que apresenta, correta e respectivamente, as características desses pares de elementos químicos.
O cariri cearense é um oásis
cultural transladando da música ao artesanato. Nesta alquimia que provoca o labor da pedra
bruta, surgem inúmeras peças das mãos
habilidosas de gente simples, que lapidam o
barro, desde a retirada da argila cavada nas
barreiras de Nova Olinda até o atelier, seja no
Crato ou em Juazeiro do Norte, onde
habilmente o barro é trabalhado. A arte
encanta na química que surge, no transformar
vidas, sejam dos artesãos aos compradores. O
barro utilizado tem em sua composição vários
componentes dentre eles se destacam íons Ca
+2
e íons Mg
+2
. Qual o número de níveis
eletrônicos são ocupados pelos elétrons do íon
Ca
+2 e qual dos íons Ca
2+ ou Mg
2+ é
isoeletrônico do íon metálico presente na
substância Aℓ2O3, respectivamente:
Recentemente, a mídia tem relatado com temor a
possibilidade de uma guerra nuclear, cujas armas são baseadas em radioatividade. As armas nucleares são basicamente de dois tipos: bomba atômica ou bomba de hidrogênio. Bombas atômicas podem ser produzidas a partir
de urânio, que existe sob as formas 235 e 238, onde ambos possuem 92 elétrons.
A fissão de uma bomba de U dá origem a dois novos
elementos 56Ba142 e 36Kr91.
Assinale a seguir a afirmação correta.
No processo de evolução da tabela periódica, os modelos de Mendeleev e Moseley foram as formulações mais
bem-sucedidas para demonstrar a periodicidade das propriedades dos elementos químicos. Nesse contexto, a
diferença básica entre os modelos de Mendeleev e Moseley residem, respectivamente, na forma de organização
dos seguintes parâmetros atômicos:
A configuração eletrônica é uma representação da distribuição
de elétrons entre os vários orbitais de um átomo.
Como no estado fundamental, os elétrons estão nas condições
de energia mais reduzida, pode-se utilizar o princípio de
exclusão de Pauli e da regra de Hund, para escrever as
distribuições dos elétrons em átomos e relacioná-las com a
localização dos elementos químicos nos grupos e períodos da
Tabela Periódica.
Considerando-se essas informações, e ao compará-las com
o elemento químico samário, é correto concluir:
A configuração eletrônica é uma representação da distribuição de elétrons entre os vários orbitais de um átomo.
Como no estado fundamental, os elétrons estão nas condições de energia mais reduzida, pode-se utilizar o princípio de exclusão de Pauli e da regra de Hund, para escrever as distribuições dos elétrons em átomos e relacioná-las com a localização dos elementos químicos nos grupos e períodos da Tabela Periódica.
Considerando-se essas informações, e ao compará-las com o elemento químico samário, é correto concluir:

Os íons Mg2+ e F−
são isoeletrônicos, entretanto o raio iônico
do ânion fluoreto, F−
, é o dobro do raio do cátion magnésio,
Mg2+. Esses íons são constituídos no processo de doação e
de recebimento de elétrons durante a formação de ligação
iônica.
Uma análise dessas informações e da tabela, tendo como
base as propriedades periódicas dos elementos químicos,
permite afirmar:

Os íons Mg2+ e F− são isoeletrônicos, entretanto o raio iônico do ânion fluoreto, F− , é o dobro do raio do cátion magnésio, Mg2+. Esses íons são constituídos no processo de doação e de recebimento de elétrons durante a formação de ligação iônica.
Uma análise dessas informações e da tabela, tendo como
base as propriedades periódicas dos elementos químicos,
permite afirmar:
Considere as informações acima e assinale a proposição CORRETA.
O cátion Po2+ apresenta 86 elétrons.
Considere as informações acima e assinale a proposição CORRETA.
O cátion Po2+ apresenta 86 elétrons.
Em abril de 1898, Marie Sklodowska Curie (1867-1934) e Pierre Curie (1859-1906), ao processar a pechblenda obtiveram duas frações radioativas. Uma delas apresentou uma radioatividade 400 vezes maior que a do urânio. O casal Curie associou essa radioatividade a um novo elemento químico, o qual foi denominado polônio, em homenagem à Polônia, terra natal de Marie Curie. O polônio foi o terceiro elemento radioativo identificado, depois do urânio e do tório, o que levou Marie Curie a receber o Prêmio Nobel de Química em 1911.
Na natureza há sete isótopos naturais do polônio, representados por: 210Po, 211Po, 212Po, 214Po, 215Po, 216Po e 218Po. Todos os isótopos desse elemento desintegram-se por emissão de partículas alfa, produzindo isótopos de chumbo. A elevada energia das partículas alfa emitidas pelo polônio permite a identificação de diminutas quantidades desse elemento em uma amostra. O polônio se dissolve em ácidos diluídos produzindo soluções contendo íons Po2+ .
Considere as informações acima e assinale a proposição CORRETA.
O isótopo 210Po possui número de nêutrons igual a 126.
Considere as informações acima e assinale a proposição CORRETA.
O isótopo 210Po possui número de nêutrons igual a 126.
Em abril de 1898, Marie Sklodowska Curie (1867-1934) e Pierre Curie (1859-1906), ao processar a pechblenda obtiveram duas frações radioativas. Uma delas apresentou uma radioatividade 400 vezes maior que a do urânio. O casal Curie associou essa radioatividade a um novo elemento químico, o qual foi denominado polônio, em homenagem à Polônia, terra natal de Marie Curie. O polônio foi o terceiro elemento radioativo identificado, depois do urânio e do tório, o que levou Marie Curie a receber o Prêmio Nobel de Química em 1911.
Na natureza há sete isótopos naturais do polônio, representados por: 210Po, 211Po, 212Po, 214Po, 215Po, 216Po e 218Po. Todos os isótopos desse elemento desintegram-se por emissão de partículas alfa, produzindo isótopos de chumbo. A elevada energia das partículas alfa emitidas pelo polônio permite a identificação de diminutas quantidades desse elemento em uma amostra. O polônio se dissolve em ácidos diluídos produzindo soluções contendo íons Po2+ .