68f6b951-fd
UFT 2018 - Química - Transformações Químicas e Energia, Eletroquímica: Oxirredução, Potenciais Padrão de Redução, Pilha, Eletrólise e Leis de Faraday.
A formação da ferrugem (corrosão do ferro) é uma reação de oxirredução entre o ferro metálico e o oxigênio do ar. Uma forma de evitar a corrosão é proteger o ferro por meio da galvanização, isto é, recobrir a superfície da peça metálica com uma película de zinco. A camada de zinco impede a oxidação do ferro porque evita que ele entre em contato com a umidade do ar. Se a peça galvanizada for riscada, o ferro tende a oxidar nesse local, mas, imediatamente, ocorre a oxidação do zinco e o ferro é reduzido novamente aferro metálico, fazendo assim a proteção.De acordo com o texto, assinale a alternativa INCORRETA.
A formação da ferrugem (corrosão do ferro) é uma reação de oxirredução entre o ferro metálico e o oxigênio do ar. Uma forma de evitar a corrosão é proteger o ferro por meio da galvanização, isto é, recobrir a superfície da peça metálica com uma película de zinco. A camada de zinco impede a oxidação do ferro porque evita que ele entre em contato com a umidade do ar. Se a peça galvanizada for riscada, o ferro tende a oxidar nesse local, mas, imediatamente, ocorre a oxidação do zinco e o ferro é reduzido novamente aferro metálico, fazendo assim a proteção.De acordo com o texto, assinale a alternativa INCORRETA.
A
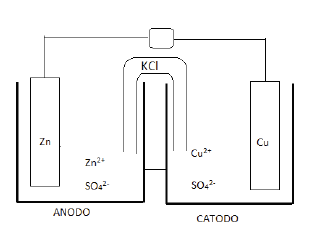
Os processos de formação da ferrugem e proteção pela galvanização funcionam como uma pilha.
B
Tanto na reação de formação da ferrugem quanto na reação de proteção à corrosão ocorrem transferências de elétrons.
C
O potencial padrão de redução do ferro é menor do que do oxigênio e o potencial padrão de redução do zinco é menor do que do ferro.
D
Na formação de ferrugem, o ferro atua como catodo e o oxigênio como anodo e na proteção do ferro galvanizado, o ferro atua como anodo e o zinco como catodo.

 Fe(s) + 2H+ (aq)
Fe(s) + 2H+ (aq)  2Fe(s) + 3H2(g)
2Fe(s) + 3H2(g)  Fe 3+ (aq) + H 2(g)
Fe 3+ (aq) + H 2(g)  Fe 2+ (aq) + H 2(g)
Fe 2+ (aq) + H 2(g)  Fe 3+ (aq) + 3H2(g)
Fe 3+ (aq) + 3H2(g)