bba29798-f7
UEG 2016 - Química - Transformações Químicas e Energia, Eletroquímica: Oxirredução, Potenciais Padrão de Redução, Pilha, Eletrólise e Leis de Faraday.
O escurecimento de talheres de prata pode ocorrer devido à presença de derivados de enxofre encontrados nos
alimentos. A equação química de oxidação e redução que representa esse processo está descrita a seguir.
4Ag(s) + 2H2S(g) + O2(g)  2Ag2S(s) + 2H2O(l)
2Ag2S(s) + 2H2O(l)
Nesse processo, o agente redutor é
O escurecimento de talheres de prata pode ocorrer devido à presença de derivados de enxofre encontrados nos
alimentos. A equação química de oxidação e redução que representa esse processo está descrita a seguir.
4Ag(s) + 2H2S(g) + O2(g)  2Ag2S(s) + 2H2O(l)
2Ag2S(s) + 2H2O(l)
 2Ag2S(s) + 2H2O(l)
2Ag2S(s) + 2H2O(l)
Nesse processo, o agente redutor é
A
sulfeto de hidrogênio
B
oxigênio gasoso
C
sulfeto de prata
D
prata metálica
E
água
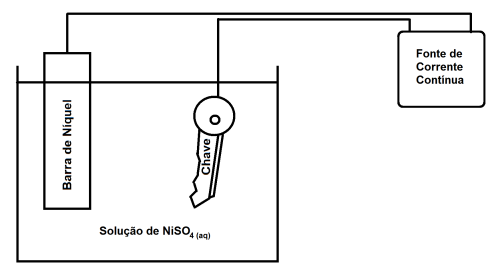
 Fe(s)
Fe(s)  Sn(s)
Sn(s) 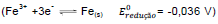 e estanho
e estanho 
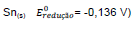 . Nesse caso, constata-se que
. Nesse caso, constata-se que
