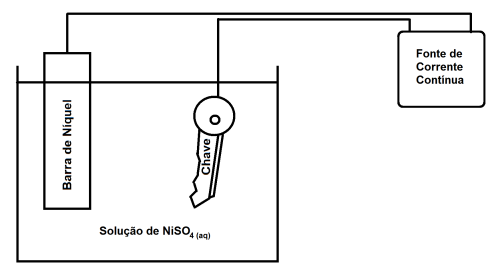
Reações de oxidorredução são reações
químicas onde ocorrem transferências de elétrons
entre duas ou mais substancias químicas. Numa
reação de oxidorredução sempre há perda e ganho
de elétrons, pois os que são perdidos por um átomo,
íon ou molécula são imediatamente recebidos por
outros. No meio em que vivemos, ocorrem muitas reações de oxidorredução. A esse respeito, assinale
a afirmação verdadeira.
ELEMENTO NÚMERO MASSA
QUÍMICO ATÔMICO ATÔMICA
H 1 1,0
C 6 12,0
N 7 14,0
O 8 16,0
F 9 19,0
Na 11 23,0
Si 14 28,1
P 15 31,0
S 16 32,0
Cl 17 35,5
K 19 39,0
Cr 24 52,0
Cu 29 63,5
As 33 75,0
Br 35 80,0
Ag 47 108,0
Sn 50 119,0
Ir 77 192,0
Au 79 197,0
Hg 80 200,0