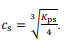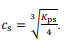Questõessobre Química
Assinale a opção correta no item que é do tipo C.
Conforme a classificação de força de um oxiácido, o H3AsO4
e o H3AsO3 são, respectivamente,
B moderado e fraco.
Assinale a opção correta no item que é do tipo C.
Conforme a classificação de força de um oxiácido, o H3AsO4 e o H3AsO3 são, respectivamente,
B moderado e fraco.
Tendo essas informações como referência inicial e considerando que, para essa reação, a 298 K, ∆G = −25 kJ/mol seja a variação da energia livre de Gibbs, que ∆H = −58,6 kJ/mol seja a variação da entalpia e que √441 = 21, julgue o item.
Considerando-se o par de elétrons não ligantes no átomo
central, a geometria molecular do composto H3AsO3 é
trigonal.
Tendo essas informações como referência inicial e considerando que, para essa reação, a 298 K, ∆G = −25 kJ/mol seja a variação da energia livre de Gibbs, que ∆H = −58,6 kJ/mol seja a variação da entalpia e que √441 = 21, julgue o item.
Considere que, em solução aquosa, o H3AsO4 sofra
três reações de dissociação ácida, cujas equações
químicas estão expressas a seguir.
H3AsO4 (aq) ⇌ H+
(aq) + H2AsO4
−
(aq)
H2AsO4
−
(aq) ⇌ H+
(aq) + HAsO4
2− (aq)
HAsO4
2− (aq) ⇌ H+
(aq) + AsO4
3− (aq)
Nessa situação, a base conjugada da espécie H2AsO4
−
é o íon
HAsO4
2−.
Tendo essas informações como referência inicial e considerando que, para essa reação, a 298 K, ∆G = −25 kJ/mol seja a variação da energia livre de Gibbs, que ∆H = −58,6 kJ/mol seja a variação da entalpia e que √441 = 21, julgue o item.
Considerando-se que, no equilíbrio, [H3AsO3] = 7 × 10−3 mol/L,
[Fe2+] = [H3AsO4] = 2,1 × 10−3 mol/L e que a constante de
equilíbrio da reação em apreço seja igual a 3 × 107
, é correto
inferir que, em pH 7, a concentração do íon Fe3+ é superior a
3 × 10−14 mol/L.
Tendo essas informações como referência inicial e considerando que, para essa reação, a 298 K, ∆G = −25 kJ/mol seja a variação da energia livre de Gibbs, que ∆H = −58,6 kJ/mol seja a variação da entalpia e que √441 = 21, julgue o item.
Na reação em tela, ocorre a oxidação do arsênio de um
estado de oxidação +3 para um +5.
Tendo essas informações como referência inicial e considerando que, para essa reação, a 298 K, ∆G = −25 kJ/mol seja a variação da energia livre de Gibbs, que ∆H = −58,6 kJ/mol seja a variação da entalpia e que √441 = 21, julgue o item.
Na reação em questão, a variação da entropia (∆S) é superior
a −0,110 kJ/mol.
A partir dessas informações e considerando que o volume molar de um gás ideal nas CNTP seja 22,4 L e que todos os gases se comportem de forma ideal, julgue o item que se segue.
Considerando-se que uma solução aquosa tenha sido preparada
dissolvendo-se 246 g de nitrato de ureia (CH5N3O4) em 1 kg de
acetonitrila (C2H3N) e sabendo-se que a pressão de vapor da
acetonitrila, a 27 °C, é igual a 100 mmHg, é correto deduzir que a
pressão máxima da solução preparada à mesma temperatura será
inferior a 93 mmHg.
A partir dessas informações e considerando que o volume molar de um gás ideal nas CNTP seja 22,4 L e que todos os gases se comportem de forma ideal, julgue o item que se segue.
Considerando-se que uma solução aquosa tenha sido preparada dissolvendo-se 246 g de nitrato de ureia (CH5N3O4) em 1 kg de acetonitrila (C2H3N) e sabendo-se que a pressão de vapor da acetonitrila, a 27 °C, é igual a 100 mmHg, é correto deduzir que a pressão máxima da solução preparada à mesma temperatura será inferior a 93 mmHg.
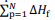 representa o somatório das
entalpias-padrão de formação dos produtos e
representa o somatório das
entalpias-padrão de formação dos produtos e 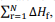 o
somatório das entalpias-padrão de formação dos reagentes.
o
somatório das entalpias-padrão de formação dos reagentes.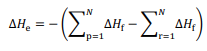
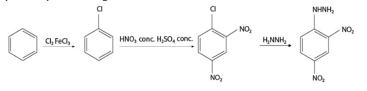
A partir dessas informações e considerando que o volume molar de um gás ideal nas CNTP seja 22,4 L e que todos os gases se comportem de forma ideal, julgue o item que se segue.
Considerada a rota sintética da DNPH, apresentada no texto,
é correto afirmar que, na reação de substituição no anel
aromático, na presença de Cl2 e FeCl3 para a obtenção de
clorobenzeno, o Cl2 atua como um ácido de Lewis e o FeCl3,
como uma base de Lewis.
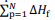 representa o somatório das
entalpias-padrão de formação dos produtos e
representa o somatório das
entalpias-padrão de formação dos produtos e 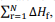 o
somatório das entalpias-padrão de formação dos reagentes.
o
somatório das entalpias-padrão de formação dos reagentes.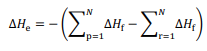

A partir dessas informações e considerando que o volume molar de um gás ideal nas CNTP seja 22,4 L e que todos os gases se comportem de forma ideal, julgue o item que se segue.
Assumindo-se que a temperatura do meio reacional aumente
25 °C com a explosão, que a pressão seja constante e que o
rendimento da reação tenha sido de 100%, conclui-se que o
volume total de gases produzidos na decomposição do RDX
será inferior a 0,95 L por grama de explosivo.
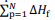 representa o somatório das
entalpias-padrão de formação dos produtos e
representa o somatório das
entalpias-padrão de formação dos produtos e 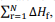 o
somatório das entalpias-padrão de formação dos reagentes.
o
somatório das entalpias-padrão de formação dos reagentes.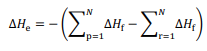

A partir dessas informações e considerando que o volume molar de um gás ideal nas CNTP seja 22,4 L e que todos os gases se comportem de forma ideal, julgue o item que se segue.
Considere que a entalpia de formação (ΔHf) do RDX seja
+83,82 kJ/mol e que os valores de ΔHf para CO, H2O e N2
sejam, respectivamente, −111,8 kJ/mol, −240,6 kJ/mol e
0,0 kJ/mol. Nessas condições, o calor liberado pela
detonação de 1 kg de RDX será inferior a 5.000 kJ.
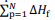 representa o somatório das
entalpias-padrão de formação dos produtos e
representa o somatório das
entalpias-padrão de formação dos produtos e 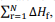 o
somatório das entalpias-padrão de formação dos reagentes.
o
somatório das entalpias-padrão de formação dos reagentes.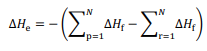

A partir dessas informações e considerando que o volume molar de um gás ideal nas CNTP seja 22,4 L e que todos os gases se comportem de forma ideal, julgue o item que se segue.
No que se refere à rota sintética da DNPH, é correto afirmar
que o halogênio ligado ao anel benzênico orienta
preferencialmente a segunda substituição eletrolítica nas
posições orto e para.
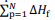 representa o somatório das
entalpias-padrão de formação dos produtos e
representa o somatório das
entalpias-padrão de formação dos produtos e 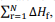 o
somatório das entalpias-padrão de formação dos reagentes.
o
somatório das entalpias-padrão de formação dos reagentes.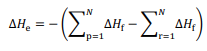

A partir dessas informações e considerando que o volume molar de um gás ideal nas CNTP seja 22,4 L e que todos os gases se comportem de forma ideal, julgue o item que se segue.
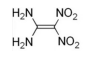
A fórmula estrutural do composto 1,1-diamino-2,2-dinitroeteno
é corretamente apresentada na figura a seguir.

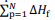 representa o somatório das
entalpias-padrão de formação dos produtos e
representa o somatório das
entalpias-padrão de formação dos produtos e 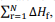 o
somatório das entalpias-padrão de formação dos reagentes.
o
somatório das entalpias-padrão de formação dos reagentes.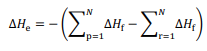

A partir dessas informações e considerando que o volume molar
de um gás ideal nas CNTP seja 22,4 L e que todos os gases se
comportem de forma ideal, julgue o item que se segue.
Considere que um dos compostos avaliados no estudo em
tela tenha sido o FOX-7, cuja fórmula mínima é CH2N2O2 e
que apresenta massa molar igual a 148 g/mol. Nessa
situação, é correto concluir que a fórmula molecular do
FOX-7 é C2H4N4O4.
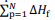 representa o somatório das
entalpias-padrão de formação dos produtos e
representa o somatório das
entalpias-padrão de formação dos produtos e 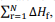 o
somatório das entalpias-padrão de formação dos reagentes.
o
somatório das entalpias-padrão de formação dos reagentes.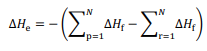

Faça o que se pede
no item que é do tipo D.
Explique por que o ligante amônia influencia a geometria
molecular do [Co(NH3)6]
2+ e por que o meio básico é
essencial para a formação do complexo.
TipoD
Faça o que se pede no item que é do tipo D.
Explique por que o ligante amônia influencia a geometria molecular do [Co(NH3)6] 2+ e por que o meio básico é essencial para a formação do complexo.
TipoD
A IA, em conjunto com a espectrofotometria UV-VIS, foi utilizada para estimar a concentração de amônia em soluções aquosas, por meio da complexação com íons cobalto (Co2+), formando o complexo [Co(NH3)6] 2+. O treino da IA é feito por meio da análise de amostras de água, com base nos dados de absorbância, aumentando-se o intervalo de detecção de forma eficiente. A reação entre o íon Co2+ e a amônia para formar o complexo [Co(NH3)6] 2+ pode ser representada pela equação a seguir, cuja constante de equilíbrio vale 1,3 × 105 .
Co2+ (aq) + 6 NH3 (aq) ⇌ [Co(NH3)6] 2+ (aq)
Considerando que a constante de Avogadro seja igual a 6,02 × 1023 mol−1, julgue o item.
O número de átomos de cobalto em 235,6 g de cobalto
metálico é superior a 2,6 × 1024.
A IA, em conjunto com a espectrofotometria UV-VIS, foi utilizada para estimar a concentração de amônia em soluções aquosas, por meio da complexação com íons cobalto (Co2+), formando o complexo [Co(NH3)6] 2+. O treino da IA é feito por meio da análise de amostras de água, com base nos dados de absorbância, aumentando-se o intervalo de detecção de forma eficiente. A reação entre o íon Co2+ e a amônia para formar o complexo [Co(NH3)6] 2+ pode ser representada pela equação a seguir, cuja constante de equilíbrio vale 1,3 × 105 .
Co2+ (aq) + 6 NH3 (aq) ⇌ [Co(NH3)6] 2+ (aq)
Considerando que a constante de Avogadro seja igual a 6,02 × 1023 mol−1, julgue o item.
Conforme o princípio de Le Châtelier, caso a reação esteja
em equilíbrio, um aumento na concentração de amônia
deslocaria o equilíbrio no sentido da formação do complexo.
A IA, em conjunto com a espectrofotometria UV-VIS, foi utilizada para estimar a concentração de amônia em soluções aquosas, por meio da complexação com íons cobalto (Co2+), formando o complexo [Co(NH3)6] 2+. O treino da IA é feito por meio da análise de amostras de água, com base nos dados de absorbância, aumentando-se o intervalo de detecção de forma eficiente. A reação entre o íon Co2+ e a amônia para formar o complexo [Co(NH3)6] 2+ pode ser representada pela equação a seguir, cuja constante de equilíbrio vale 1,3 × 105 .
Co2+ (aq) + 6 NH3 (aq) ⇌ [Co(NH3)6] 2+ (aq)
Considerando que a constante de Avogadro seja igual a 6,02 × 1023 mol−1, julgue o item.
O nitrogênio é mais propenso a formar ligações duplas e
triplas que o fósforo, devido ao seu menor raio atômico e à
sua maior eletronegatividade.
A IA, em conjunto com a espectrofotometria UV-VIS, foi utilizada para estimar a concentração de amônia em soluções aquosas, por meio da complexação com íons cobalto (Co2+), formando o complexo [Co(NH3)6] 2+. O treino da IA é feito por meio da análise de amostras de água, com base nos dados de absorbância, aumentando-se o intervalo de detecção de forma eficiente. A reação entre o íon Co2+ e a amônia para formar o complexo [Co(NH3)6] 2+ pode ser representada pela equação a seguir, cuja constante de equilíbrio vale 1,3 × 105 .
Co2+ (aq) + 6 NH3 (aq) ⇌ [Co(NH3)6] 2+ (aq)
Considerando que a constante de Avogadro seja igual a 6,02 × 1023 mol−1, julgue o item.
O valor da constante de equilíbrio da reação em apreço
indica que a decomposição do complexo [Co(NH3)6]
2+ é
favorecida.
A IA, em conjunto com a espectrofotometria UV-VIS, foi
utilizada para estimar a concentração de amônia em soluções
aquosas, por meio da complexação com íons cobalto (Co2+),
formando o complexo [Co(NH3)6]
2+. O treino da IA é feito por
meio da análise de amostras de água, com base nos dados de
absorbância, aumentando-se o intervalo de detecção de forma
eficiente. A reação entre o íon Co2+ e a amônia para formar o
complexo [Co(NH3)6]
2+ pode ser representada pela equação a
seguir, cuja constante de equilíbrio vale 1,3 × 105
.
Co2+ (aq) + 6 NH3 (aq) ⇌ [Co(NH3)6]
2+ (aq)
Considerando que a constante de Avogadro seja igual a
6,02 × 1023 mol−1, julgue o item.
Considere que, para a preparação do complexo, seja utilizada
uma solução de cloreto de cobalto (II) anidro (CoCl2). Nesse
caso, a relação entre o produto de solubilidade (Kps) do
CoCl2 e sua solubilidade molar (cs) seriam corretamente
representados por