UFSC aprova Instituto Nacional de Ciência e Tecnologia de Catálise em Sistemas Moleculares e Nanoestruturados.
O INCT de Catálise em Sistemas Moleculares e Nanoestruturados terá sua sede no Departamento de Química da UFSC, agregando o trabalho de 15 laboratórios. Receberá nos próximos três anos cerca de R$ 4,7 milhões para o desenvolvimento de pesquisas e estruturação de uma rede nacional formada por mais de 350 membros dos estados de Santa Catarina, Rio Grande do Sul, São Paulo, Minas Gerais, Rio de Janeiro, Alagoas e do Distrito Federal. São pesquisadores sêniores (líderes de grupos em diferentes universidades), mestrandos, doutorandos, pós-doutores e também estudantes de iniciação científica. O INCT pretende estudar o papel de catalisadores na obtenção de plásticos, no biodiesel, em terapias genéticas, dentre outros assuntos.
Disponível em: <http://www.agecom.ufsc.br> Acesso em: 03 set. 2010. (Adaptado)
Sobre o assunto, assinale a proposição CORRETA.
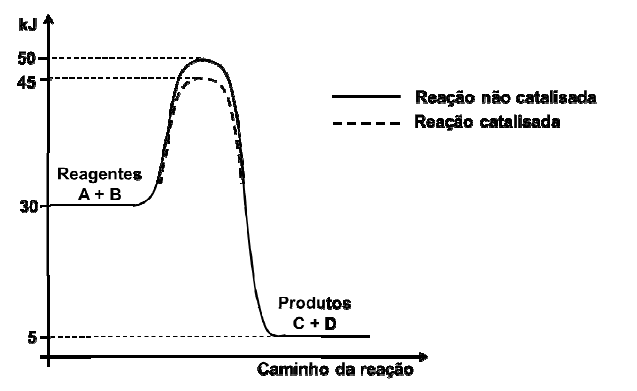
Uma reação endotérmica pode se tornar exotérmica na presença de um catalisador.
UFSC aprova Instituto Nacional de Ciência e Tecnologia de Catálise em Sistemas Moleculares e Nanoestruturados.
O INCT de Catálise em Sistemas Moleculares e Nanoestruturados terá sua sede no Departamento de Química da UFSC, agregando o trabalho de 15 laboratórios. Receberá nos próximos três anos cerca de R$ 4,7 milhões para o desenvolvimento de pesquisas e estruturação de uma rede nacional formada por mais de 350 membros dos estados de Santa Catarina, Rio Grande do Sul, São Paulo, Minas Gerais, Rio de Janeiro, Alagoas e do Distrito Federal. São pesquisadores sêniores (líderes de grupos em diferentes universidades), mestrandos, doutorandos, pós-doutores e também estudantes de iniciação científica. O INCT pretende estudar o papel de catalisadores na obtenção de plásticos, no biodiesel, em terapias genéticas, dentre outros assuntos.
Disponível em: <http://www.agecom.ufsc.br>
Sobre o assunto, assinale a proposição CORRETA.
Uma reação endotérmica pode se tornar exotérmica na presença de um catalisador.









 2HI(g) v = k[H
2HI(g) v = k[H