
Considere um experimento em que uma enzima, cuja constante de Michaelis é igual a
9 x 10−3
milimol/L, foi incubada em condições ideais, com concentração de substrato
igual a 10−3
milimol/L. A velocidade de reação medida correpondeu a 10 unidades. Em
seguida, a concentração de substrato foi bastante elevada de modo a manter essa enzima
completamente saturada.
Neste caso, a velocidade de reação medida será, nas mesmas unidades, equivalente a:

Considere um experimento em que uma enzima, cuja constante de Michaelis é igual a 9 x 10−3 milimol/L, foi incubada em condições ideais, com concentração de substrato igual a 10−3 milimol/L. A velocidade de reação medida correpondeu a 10 unidades. Em seguida, a concentração de substrato foi bastante elevada de modo a manter essa enzima completamente saturada.
Neste caso, a velocidade de reação medida será, nas mesmas unidades, equivalente a:





 = 4
= 4 .
.

 e
e  são as velocidades
características das moléculas de H
são as velocidades
características das moléculas de H
 NO
NO O
O

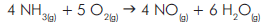
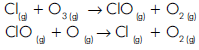
 2HI(g) v = k[H2] [I
2HI(g) v = k[H2] [I

