c6e2cd5e-96
CEDERJ 2014 - Química - Isomeria: Isomeria Espacial: Isomeria Geométrica (cis-trans) e Isomeria Óptica., Química Orgânica, Isomeria: Isomeria Plana: Cadeia, Posição, Compensação, Função e Tautomeria.
O hidrocarboneto de fórmula molecular C6H14
apresenta cinco formas isoméricas: n-hexano;
2-metilpentano; 3-metilpentano; 2,3-dimetilbutano e
2,2-dimetilbutano. Sobre os compostos apresentados,
pode-se afirmar que
O hidrocarboneto de fórmula molecular C6H14
apresenta cinco formas isoméricas: n-hexano;
2-metilpentano; 3-metilpentano; 2,3-dimetilbutano e
2,2-dimetilbutano. Sobre os compostos apresentados,
pode-se afirmar que
A
os dois últimos compostos são isômeros
geométricos cis-trans.
B
o composto 2,3-dimetil butano é opticamente ativo,
pois se apresenta constituído de um carbono
assimétrico (quiral).
C
o composto 3-metilpentano é um isômero de cadeia
do composto metil ciclopentadieno 1,4.
D
nenhum dos compostos apresentados é
opticamente ativo.

 NH4(aq) + OH−
(aq) , assinale a alternativa que
apresenta a concentração do íon OH−
em mol/L e o pH da
solução nas condições dadas. Considere que para o
hidróxido de amônio Kb=1,0x10-5.
NH4(aq) + OH−
(aq) , assinale a alternativa que
apresenta a concentração do íon OH−
em mol/L e o pH da
solução nas condições dadas. Considere que para o
hidróxido de amônio Kb=1,0x10-5. 2SO2(g) + O2(g)
2SO2(g) + O2(g)
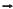 Al 2 O3(s) , não balanceada, pode-se afirmar que a massa de alumínio necessária para produzir 51 g de óxido de alumínio é
Al 2 O3(s) , não balanceada, pode-se afirmar que a massa de alumínio necessária para produzir 51 g de óxido de alumínio é