Questõessobre Gás Ideal
Um recipiente cilíndrico, provido de um
êmbolo móvel, contém dois mols de um gás
ideal. O sistema sofre uma expansão isotérmica
AB, conforme mostra o gráfico (p x V) a seguir.
 Considerando a constante universal dos
gases, R = 8,3 J/mol.K, analise as proposições
a seguir:
Considerando a constante universal dos
gases, R = 8,3 J/mol.K, analise as proposições
a seguir:
I. A temperatura do gás permanece constante
durante a transformação.
II. O volume inicial do gás é VA = 40 litros.
III. A temperatura final TB = 289 K.
Está(ão) correta(s):

As máquinas térmicas são dispositivos que operam
sempre em ciclos, isto é, retornam periodicamente às
condições iniciais. Uma maneira de estudá-las é por meio
de transformações que ocorrem dentro destes ciclos,
representados por um gráfico do comportamento da
pressão de um gás de trabalho em função do volume por
ele ocupado.
O gráfico a seguir representa um ciclo de uma
máquina térmica realizado por um sistema gasoso:  Analise as afirmativas.
I. De A para B ocorre uma expansão isobárica.
II. De B para C o trabalho é motor, ou seja, realizado
pelo sistema.
III. A variação de energia interna no ciclo ABCDA é
positiva.
IV. No ciclo fechado, ABCDA, não há variação de energia
interna e o trabalho total é nulo.
Analise as afirmativas.
I. De A para B ocorre uma expansão isobárica.
II. De B para C o trabalho é motor, ou seja, realizado
pelo sistema.
III. A variação de energia interna no ciclo ABCDA é
positiva.
IV. No ciclo fechado, ABCDA, não há variação de energia
interna e o trabalho total é nulo.
Está(ão) correta(s).

Uma determinada amostra de
gás ideal pode sofrer diversas transformações
indicadas na figura, todas com finalidade de
levar o gás do estado inicial “a” para o estado
final "c”. Verifica-se que se for realizada a
transformação por meio do percurso a ➔ d ➔ c
fornecendo-se 200 calorias de calor ao gás, há
possibilidade de realização de um trabalho de
20 cal. Entretanto, se a transformação ocorrer
por meio do percurso a ➔ b ➔ c com o
fornecimento de 244 cal de calor ao gás,
poderemos obter:


A experiência mostra que, para todos os gases, as grandezas volume, V, temperatura, T, e
pressão, p, obedecem, aproximadamente, a uma equação denominada Equação de Clapeyron,
desde que os gases tenham baixas densidades, isso é, as temperaturas não devem ser muito
“baixas” e as pressões não devem ser muito “altas”. Isso levou os físicos a formularem o conceito
de gás ideal, que obedece à Equação de Clapeyron, em quaisquer condições.
Considere um recipiente em que há 3,0 litros do gás nitrogênio, N2, à pressão de 5,0atm e à
temperatura T. Em um segundo recipiente, há 2,0 litros do gás oxigênio, O2, à pressão de 4,0atm
e à mesma temperatura T. Esses gases são misturados em um recipiente de volume 10,0 litros,
mantido à mesma temperatura T.
Com base nessas informações, é correto afirmar:
Um sistema gasoso ocupa um volume de 0,8m3
sob pressão de 400N/m2
. Ao receber 600J de
calor, o sistema expande, sob pressão constante, atingindo um volume de 1,3m3
.
Desprezando-se perdas de calor para o meio ambiente, é correto afirmar que o trabalho realizado
e a variação de energia interna do gás, em kJ, são, respectivamente, iguais a
Um cilindro, dotado de um êmbolo, contém inicialmente no seu interior 2,0 litros de um gás ideal
a uma pressão p e temperatura T.
Diminuindo-se sua pressão em 40% e aumentando-se seu volume em 60%, sua temperatura
será igual a
Gás natural veicular (GNV) é um combustível disponibilizado na forma gasosa, a cada dia mais utilizado
em automóveis como alternativa à substituição do consumo de gasolina e álcool. Uma das técnicas para
obter um abastecimento do gás natural preenchendo com mais conteúdo o cilindro é o resfriamento do
gás. Suponha que um automóvel possua um cilindro de 15m3
e que, ao utilizar-se o processo de
abastecimento com resfriamento, o gás retido no cilindro esteja a 7 ºC, com pressão de 140 atm. Após um
certo tempo decorrido, ao final do abastecimento, as trocas de calor entre o gás, o cilindro e o ambiente
externo fazem com que a temperatura interna do cilindro passe a 17 °C. Determine a pressão do gás GNV
dentro do cilindro a 17°C, sabendo que a transformação gasosa em seu interior consiste numa
transformação isovolumétrica.
O gráfico abaixo mostra a variação da energia
interna de um gás ideal que sofreu uma
transformação à pressão constante de P= 120
N/m2
. A quantidade de calor recebida pelo gás
durante o processo foi de 800 joules.

Com os dados, pode-se dizer que a variação da
energia interna que este gás sofreu foi de:

O gráfico apresenta o comportamento de um gás ideal em
um processo cíclico que se inicia no ponto A.
Com base no gráfico apresentado, podemos afirmar
corretamente que


Três amostras de um gás ideal, com massas
iguais e volumes V1, V2 e V3, têm suas
temperaturas aumentadas conforme o gráfico a

Assim, a relação entre os volumes é

Assinale a alternativa correta.
A figura apresenta três possíveis transformações de fase de um gás, desde o estado a até o estado c. Na
transformação de a até c, ao longo do caminho curvo do diagrama PV , o trabalho realizado pelo gás é de
W = −35J e o calor absorvido pelo gás é Q = −63J. Ao longo do caminho abc, o trabalho realizado pelo gás
é de W = −48J.
Com base na figura, no enunciado e nos conhecimentos sobre o assunto, considere as afirmativas a seguir.
I. Para o caminho abc, a quantidade de calor Q absorvida pelo gás vale −76J.
II. Se a pressão Pc = 1/2 Pb, o trabalho W para o caminho cda vale 14J.
III. Se a diferença de energia interna Ud − Uc = 15J, a quantidade de calor Q cedida para o caminho da vale
15J.
IV. Se a diferença de energia interna Ud − Uc = 5J, a quantidade de calor Q cedida para o caminho da vale
23J.
Assinale a alternativa correta.
Analise a figura a seguir e responda a questão.

Em 1824 o engenheiro francês Nicolas Léonard Sadi Carnot
demonstrou que se uma máquina térmica, operando entre duas
temperaturas constantes T1
e T2
(com T1
> T2
), trabalhasse em
ciclos segundo o gráfico mostrado, apresentaria o maior rendimento possível para essas temperaturas. Esse ciclo passou a
se chamar Ciclo de Carnot e essa máquina, máquina ideal ou
máquina de Carnot.
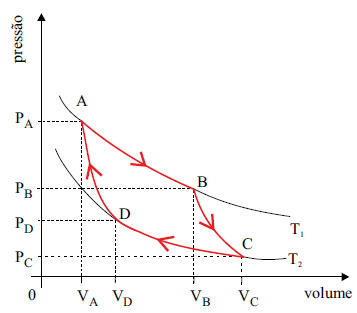
No Ciclo de Carnot um gás ideal sofre quatro transformações
reversíveis: duas isotérmicas (AB e CD) e duas adiabáticas
(BC e DA). A respeito da máquina e do Ciclo de Carnot, é
correto afirmar que

Observe a figura abaixo.

A figura mostra dois processos, I e II, em um
diagrama pressão (P) x volume (V) ao longo
dos quais um gás ideal pode ser levado do
estado inicial i para o estado final f.
Assinale a alternativa que preenche
corretamente as lacunas do enunciado abaixo,
na ordem em que aparecem.
De acordo com a 1ª Lei da Termodinâmica, a
variação da energia interna é ........ nos dois
processos. O trabalho WI realizado no
processo I é ........ que o trabalho WII
realizado no processo II.
Observe a figura abaixo.

A figura mostra dois processos, I e II, em um diagrama pressão (P) x volume (V) ao longo dos quais um gás ideal pode ser levado do estado inicial i para o estado final f.
Assinale a alternativa que preenche corretamente as lacunas do enunciado abaixo, na ordem em que aparecem.
De acordo com a 1ª Lei da Termodinâmica, a
variação da energia interna é ........ nos dois
processos. O trabalho WI realizado no
processo I é ........ que o trabalho WII
realizado no processo II.
Considere um tubo vertical fechado na extremidade
inferior que aprisiona um gás ideal em seu interior por meio
de um leve êmbolo situado na extremidade oposta. Lentamente, o êmbolo é pressionado até que o volume do gás
se reduz à metade. Considere duas formas de fazer isso.
No processo I, o tubo é mantido em contato térmico com
um grande recipiente com água. No processo II, o tubo é
isolado termicamente do ambiente.
As descrições dos processos I e II e a avaliação das variações de energia interna correspondem a:
Um gás ideal, inicialmente na pressão p1 = 0,3atm, ocupa um volume V1 = 0,1 litro e está a uma
temperatura T1 = 300,0K sendo aquecido à pressão constante até atingir o volume V2 = 0,4 litros.
Considerando-se 1,0atm = 105
N/m2
, é correto afirmar:
Um gás ideal, inicialmente na pressão p1 = 0,3atm, ocupa um volume V1 = 0,1 litro e está a uma temperatura T1 = 300,0K sendo aquecido à pressão constante até atingir o volume V2 = 0,4 litros.
Considerando-se 1,0atm = 105 N/m2 , é correto afirmar:
Certa quantidade de gás ideal ocupa inicialmente um volume V0
, à pressão p0
e temperatura T0
. Esse gás se expande
à temperatura constante e realiza trabalho sobre o sistema, o qual é representado nos gráficos pela área sob a curva.
Assinale a alternativa que melhor representa a variação de energia.
Certa quantidade de gás ideal ocupa inicialmente um volume V0 , à pressão p0 e temperatura T0 . Esse gás se expande à temperatura constante e realiza trabalho sobre o sistema, o qual é representado nos gráficos pela área sob a curva.
Assinale a alternativa que melhor representa a variação de energia.

Glossário de Matemática
sen 30° =5 cos 30°= √3/2 ≈0,9 sen 60° = √3/2 ≈0,9
sen 45°= √2/2 ≈0,7 cos 45°= √2/2 ≈0,7 cos 60° = 0,5
Deve-se considerar para todos os problemas
c = 3,0 x 108 m/s vsom = 340m/s g = 10m /s2 G = 6 x 10-11 N.m2 /Kg2
R = 0,08atm.L / mol.K h = 6 x 10-34 J.s 1eV = 1,6 x 10-19 J




Um garrafão de vidro hermeticamente fechado
contendo um gás ideal é exposto ao sol.
Assinale a alternativa que descreve corretamente a variação
da temperatura do gás (ΔT) e o trabalho (W) realizado sobre
esse gás devido à exposição ao sol, desprezando-se a
dilatação do garrafão.
Assinale a alternativa que preenche corretamente as lacunas do enunciado abaixo, na ordem em que
aparecem.
No processo I, o gás sofre duas transformações sucessivas, sendo a primeira ........ e a segunda ........ .
A variação de energia interna no processo I, ∆UI, é ........ variação de energia interna no processo II, ∆UII.
Assinale a alternativa que preenche corretamente as lacunas do enunciado abaixo, na ordem em que aparecem.
No processo I, o gás sofre duas transformações sucessivas, sendo a primeira ........ e a segunda ........ .
A variação de energia interna no processo I, ∆UI, é ........ variação de energia interna no processo II, ∆UII.
Um gás ideal contido em um cilindro com pistão pode ser levado de um estado inicial i até um estado final f, seguindo dois processos distintos, I e II, conforme ilustrado na figura abaixo.
